FRAGMINE®
daltéparine sodique
FORMES et PRÉSENTATIONS |
Solution injectable à 7500 UI anti-Xa/0,75 ml et à 10 000 UI anti-Xa/1 ml : Seringues préremplies, boîtes de 2 et de 10.
Solution injectable à 10 000 UI anti-Xa/0,4 ml, à 12 500 UI anti-Xa/0,5 ml, à 15 000 UI anti-Xa/0,6 ml et à 18 000 UI anti-Xa/0,72 ml : Seringues préremplies, boîtes de 5.
Solution injectable à 7500 UI anti-Xa/0,3 ml : Seringues préremplies, boîte de 10.
COMPOSITION |
| p seringue | ||
| Daltéparine sodique (DCI) | 2500 UI anti-Xa | |
| ou | 5000 UI anti-Xa | |
| ou | 7500 UI anti-Xa | |
| ou | 10 000 UI anti-Xa | |
| ou | 12 500 UI anti-Xa | |
| ou | 15 000 UI anti-Xa | |
| ou | 18 000 UI anti-Xa | |
Sol inj à 5000 UI/0,2 ml : eau ppi.
Sol inj à 2500 UI/0,2 ml, à 7500 UI/0,75 ml et à 10 000 UI/1 ml : chlorure de sodium, eau ppi.
Sol inj à 7500 UI/0,3 ml, à 10 000 UI/0,4 ml, à 12 500 UI/0,5 ml, à 15 000 UI/0,6 ml et à 18 000 UI/0,72 ml : hydroxyde de sodium, acide chlorhydrique, eau ppi.
1 ml de Fragmine 2500 UI anti-Xa/0,2 ml correspond environ à 12 500 Ul anti-Xa de daltéparine sodique.
1 ml de Fragmine 5000 UI anti-Xa/0,2 ml correspond environ à 25 000 Ul anti-Xa de daltéparine sodique.
1 ml de Fragmine 7500 UI anti-Xa/0,3 ml correspond environ à 25 000 U.I. anti-Xa de daltéparine sodique.
1 ml de Fragmine 7500 Ul anti-Xa/0,75 ml correspond environ à 10 000 Ul anti-Xa de daltéparine sodique.
1 ml de Fragmine 10 000 UI anti-Xa/0,4 ml correspond environ à 25 000 Ul anti-Xa de daltéparine sodique.
1 ml de Fragmine 10 000 UI anti-Xa/1 ml correspond environ à 10 000 Ul anti-Xa de daltéparine sodique.
1 ml de Fragmine 12 500 UI anti-Xa/0,5 ml correspond environ à 25 000 UI anti-Xa de daltéparine sodique.
1 ml de Fragmine 15 000 UI anti-Xa/0,6 ml correspond environ à 25 000 UI anti-Xa de daltéparine sodique.
1 ml de Fragmine 18 000 UI anti-Xa/0,72 ml correspond environ à 25 000 UI anti-Xa de daltéparine sodique.
INDICATIONS |
- Solutions injectables à 2500 UI anti-Xa/0,2 ml, à 5000 UI anti-Xa/0,2 ml, à 7500 UI anti-Xa/0,75 ml et à 10 000 UI anti-Xa/1 ml :
-
- Prévention de la coagulation du circuit de circulation extracorporelle au cours de l'hémodialyse (séances en général d'une durée <= 4 heures).
- Prévention de la coagulation du circuit de circulation extracorporelle au cours de l'hémodialyse (séances en général d'une durée <= 4 heures).
- Solution injectable à 5000 UI anti-Xa/0,2 ml :
-
- Traitement prophylactique des thromboses veineuses profondes chez les patients alités pour une affection médicale aiguë :
- une insuffisance cardiaque de stade III ou IV de la classification NYHA,
- une insuffisance respiratoire aiguë,
- ou un épisode d'infection aiguë ou d'affection rhumatologique aiguë, associé à au moins un autre facteur de risque thromboembolique veineux.
- une insuffisance cardiaque de stade III ou IV de la classification NYHA,
- Traitement prophylactique des thromboses veineuses profondes chez les patients alités pour une affection médicale aiguë :
- Solutions injectables à 2500 UI et à 5000 UI anti-Xa/0,2 ml :
-
- Traitement prophylactique de la maladie thromboembolique veineuse en chirurgie, dans les situations à risque modéré ou élevé ainsi qu'en chirurgie oncologique.
- Traitement prophylactique de la maladie thromboembolique veineuse en chirurgie, dans les situations à risque modéré ou élevé ainsi qu'en chirurgie oncologique.
- Solutions injectables à 7500 UI anti-Xa/0,75 ml et à 10 000 UI anti-Xa/1 ml :
-
- Traitement curatif des thromboses veineuses profondes constituées.
- Traitement de l'angor instable et de l'infarctus du myocarde sans onde Q à la phase aiguë, en association avec l'aspirine.
- Traitement curatif des thromboses veineuses profondes constituées.
- Solutions injectables à 7500 UI anti-Xa/0,3 ml, à 10 000 UI anti-Xa/0,4 ml, à 12 500 UI anti-Xa/0,5 ml, à 15 000 UI anti-Xa/0,6 ml et à 18 000 UI anti-Xa/0,72 ml :
-
- Traitement prolongé de la maladie thromboembolique veineuse symptomatique et prévention de ses récidives, chez les patients cancéreux.
- Traitement prolongé de la maladie thromboembolique veineuse symptomatique et prévention de ses récidives, chez les patients cancéreux.
POSOLOGIE ET MODE D'ADMINISTRATION |
- Ces présentations sont adaptées à l'adulte.
- Voie sous-cutanée (en dehors de l'indication en hémodialyse).
- Ne pas injecter par voie IM.
- Solutions injectables à 2500 UI anti-Xa/0,2 ml et à 5000 UI anti-Xa/0,2 ml : les seringues préremplies à 2500 UI et à 5000 UI anti-Xa de daltéparine se présentent sous un volume identique (0,2 ml). Pour l'utilisation du système de sécurité de l'aiguille : cf Modalités de manipulation et d'élimination.
- Solutions injectables à 7500 UI anti-Xa/0,3 ml, à 10 000 UI anti-Xa/0,4 ml, à 12 500 UI anti-Xa/0,5 ml, à 15 000 UI anti-Xa/0,6 ml et à 18 000 UI anti-Xa/0,72 ml : une seule injection par jour.
- Technique de l'injection sous-cutanée :
- L'injection sous-cutanée de la daltéparine doit être réalisée de préférence chez le patient en décubitus, dans le tissu cellulaire sous-cutané de la ceinture abdominale antérolatérale et postérolatérale, alternativement du côté droit et du côté gauche, ou sur la face antérieure des cuisses en cas d'intolérance locale.
- L'aiguille doit être introduite perpendiculairement, et non tangentiellement, sur toute sa longueur, dans l'épaisseur d'un pli cutané réalisé entre le pouce et l'index de l'opérateur. Ce pli cutané doit être maintenu pendant toute la durée de l'injection.
- Ne pas purger la bulle d'air dans les seringues préremplies.
- Recommandation générale :
- La surveillance régulière de la numération plaquettaire est impérative pendant toute la durée du traitement en raison du risque de thrombopénie induite par l'héparine (TIH) : cf Mises en garde et Précautions d'emploi. Voir également ci-dessous la conduite à tenir en cas de thrombopénie induite par la chimiothérapie.
- Prévention de la coagulation du circuit de circulation extracorporelle au cours de l'hémodialyse :
-
- Solutions injectables à 2500 UI anti-Xa/0,2 ml, à 5000 UI anti-Xa/0,2 ml, à 7500 UI anti-Xa/0,75 ml et à 10 000 UI anti-Xa/1 ml :
- Injection par voie intravasculaire (dans la ligne artérielle du circuit de la dialyse).
- Chez les patients bénéficiant de séances d'hémodialyse itératives, la prévention de la coagulation dans le circuit d'épuration extrarénale est obtenue en injectant une dose initiale de 5000 UI anti-Xa dans la ligne artérielle du circuit de dialyse, en début de séance.
- Cette dose, administrée en bolus intravasculaire unique, n'est adaptée que pour les séances de dialyse de 4 heures ou moins. Elle est susceptible d'être modifiée ultérieurement, en raison de l'importante variabilité intra et interindividuelle et de la durée de la séance.
- De plus, les posologies recommandées pour des séances > 4 heures sont :
- dose initiale : injection directe de 30 à 35 UI anti-Xa/kg ;
- dose d'entretien : perfusion de 10 à 15 UI anti-Xa/kg/h.
- dose initiale : injection directe de 30 à 35 UI anti-Xa/kg ;
- Traitement curatif des thromboses veineuses profondes (TVP) :
-
- Solutions injectables à 7500 UI anti-Xa/0,75 ml et à 10 000 UI anti-Xa/1 ml :
- Toute suspicion de thrombose veineuse profonde doit être confirmée rapidement par des examens adaptés.
-
- Fréquence d'administration :
- 2 injections par jour espacées de 12 heures.
-
- Dose administrée :
- La dose par injection est de 100 UI anti-Xa/kg.
- La posologie des HBPM n'a pas été évaluée en fonction du poids corporel chez les patients d'un poids supérieur à 100 kg ou inférieur à 40 kg. Il peut apparaître une moindre efficacité des HBPM pour les patients de poids supérieur à 100 kg, ou un risque hémorragique accru pour les patients de poids inférieur à 40 kg. Une surveillance clinique particulière s'impose.
-
- Durée de traitement des TVP :
- Le traitement par HBPM doit être relayé rapidement par les anticoagulants oraux, sauf contre-indication.
- La durée du traitement par HBPM ne doit pas excéder 10 jours, délai d'équilibration par les AVK inclus, sauf en cas de difficultés d'équilibration (cf Mises en garde et Précautions d'emploi : surveillance plaquettaire). Le traitement anticoagulant oral doit donc être débuté le plus tôt possible.
- Coût du traitement journalier : 13,41 à 15,07 euro(s) (7500 UI/0,75 ml) ; 16,74 à 18,98 euro(s) (10 000 UI/1 ml).
- Traitement curatif de l'angor instable et de l'infarctus du myocarde sans onde Q :
-
- Solution injectable à 7500 UI anti-Xa/0,75 ml et à 10 000 UI anti-Xa/1 ml :
- La daltéparine sodique est administrée en 2 injections sous-cutanées par jour (espacées de 12 heures), de 120 UI anti-Xa/kg chacune, avec une dose maximale de 10 000 UI par injection, en association avec l'aspirine (posologies recommandées : 75 à 325 mg par voie orale, après une dose de charge minimale de 160 mg).
- La durée recommandée de traitement est de 6 jours environ jusqu'à stabilisation clinique.
- Si un traitement thrombolytique s'avère nécessaire, en l'absence de données cliniques sur l'administration conjointe de daltéparine et de thrombolytique, il est recommandé d'interrompre le traitement par la daltéparine et de prendre en charge ce patient de façon habituelle.
- Coût du traitement journalier : 13,41 à 15,07 euro(s) (7500 UI/0,75 ml) ; 16,74 à 18,98 euro(s) (10 000 UI/1 ml).
- Traitement prophylactique de la maladie thromboembolique veineuse en chirurgie :
-
- Solutions injectables à 2500 UI et à 5000 UI anti-Xa/0,2 ml :
- Ces recommandations s'appliquent en règle générale aux interventions chirurgicales effectuées sous anesthésie générale.
- Pour les techniques de rachianesthésie et d'anesthésie péridurale, l'intérêt de l'injection préopératoire doit être évalué en raison du risque théorique accru d'hématome intrarachidien (cf Mises en garde et Précautions d'emploi).
-
- Fréquence d'administration :
- 1 injection par jour.
-
- Dose administrée :
- Elle doit être fonction du niveau de risque individuel, lié au patient et au type de chirurgie.
-
- Situation à risque thrombogène modéré :
Dans le cas d'une chirurgie à risque thrombogène modéré et lorsque les patients ne présentent pas de risque thromboembolique élevé, la prévention efficace de la maladie thromboembolique est obtenue par une injection quotidienne d'une dose de 2500 UI anti-Xa.
Le schéma thérapeutique étudié comporte une première injection effectuée 2 heures avant l'intervention.
Coût du traitement journalier : 3,26 à 3,44 euro(s). - Situation à risque thrombogène élevé :
- Chirurgie de la hanche et du genou :
La posologie est de 5000 UI anti-Xa, à raison d'une injection quotidienne.
La première injection sera pratiquée :- soit dans les 2 heures avant l'intervention dans le cas d'une moitié de dose (2500 UI anti-Xa) ; la même dose sera renouvelée 12 heures plus tard ;
- soit le soir précédant l'intervention dans le cas d'une dose totale (5000 UI anti-Xa) ; la même dose sera renouvelée 24 heures plus tard.
- soit dans les 2 heures avant l'intervention dans le cas d'une moitié de dose (2500 UI anti-Xa) ; la même dose sera renouvelée 12 heures plus tard ;
- Autres situations :
Lorsque le risque thromboembolique lié au type de chirurgie (notamment cancérologique) et/ou au patient (notamment antécédents de maladie thromboembolique) paraît majoré, on peut envisager le recours à une posologie prophylactique identique à celle de l'orthopédie à risque élevé (hanche, genou).
En chirurgie oncologique, la daltéparine a établi son efficacité à la posologie de 5000 UI anti-Xa par jour, selon le même schéma posologique qu'en chirurgie orthopédique de hanche.
- Chirurgie de la hanche et du genou :
- Situation à risque thrombogène modéré :
-
- Durée de traitement :
- Le traitement par HBPM, accompagné des techniques habituelles de contention élastique des membres inférieurs, doit être maintenu jusqu'à déambulation active et complète du patient :
-
- en chirurgie générale, la durée du traitement par HBPM doit être inférieure à 10 jours, en dehors d'un risque thromboembolique veineux particulier lié au patient (cf Mises en garde et Précautions d'emploi : surveillance plaquettaire) ;
- l'intérêt d'un traitement prophylactique en chirurgie orthopédique de hanche, par une injection de daltéparine sodique à la dose de 5000 UI anti-Xa/j durant 35 jours après l'intervention, a été établi ;
- si le risque thromboembolique veineux persiste au-delà de la période de traitement recommandée, il est nécessaire d'envisager la poursuite de la prophylaxie, notamment par les anticoagulants oraux.
Toutefois, le bénéfice clinique d'un traitement à long terme par héparine de bas poids moléculaire ou par antivitamine K n'est pas évalué à l'heure actuelle.
- en chirurgie générale, la durée du traitement par HBPM doit être inférieure à 10 jours, en dehors d'un risque thromboembolique veineux particulier lié au patient (cf Mises en garde et Précautions d'emploi : surveillance plaquettaire) ;
- Traitement prophylactique en milieu médical :
-
- Solution injectable à 5000 UI anti-Xa/0,2 ml :
-
- Dose administrée : La posologie est de 5000 UI anti-Xa/0,2 ml, à raison d'une injection sous-cutanée par jour.
- Durée du traitement :
Le bénéfice du traitement a été établi pour une durée de traitement comprise entre 12 et 14 jours.
Aucune donnée n'est actuellement disponible concernant l'efficacité et la sécurité d'une prophylaxie prolongée au-delà de 14 jours. Si les facteurs de risque thromboemboliques persistent, il est nécessaire d'envisager un traitement prophylactique prolongé, notamment par anti-vitamine K.
- Dose administrée : La posologie est de 5000 UI anti-Xa/0,2 ml, à raison d'une injection sous-cutanée par jour.
- Coût du traitement journalier : 6,26 euro(s) à 6,61 euro(s).
- Traitement prolongé de la maladie thromboembolique veineuse symptomatique et prévention de ses récidives pendant le 1er mois suivant l'événement :
-
- Solutions injectables à 7500 UI anti-Xa/0,3 ml, à 10 000 UI anti-Xa/0,4 ml, à 12 500 UI anti-Xa/0,5 ml, à 15 000 UI anti-Xa/0,6 ml et à 18 000 UI anti-Xa/0,72 ml :
-
-
- Fréquence d'administration :
1 seule injection par jour.
- Fréquence d'administration :
-
-
-
- Dose administrée :
La dose par injection est de 200 UI anti-Xa/kg. La dose maximale quotidienne ne doit pas excéder 18000 UI.
Le flacon* sera utilisé avec des seringues d'un volume maximum de 1 ml et graduées de 0,01 ml en 0,01 ml.
Le tableau ci-dessous présente des exemples de volumes à administrer par jour en fonction du poids corporel du patient. Les seringues préremplies pourront être également utilisées lorsque le poids des patients correspond aux dosages.
Une surveillance régulière du poids des patients cancéreux est nécessaire pour ajuster le traitement en fonction d'un poids récent.Poids corporel
(kg)Volume (ml) de daltéparine recommandé par injection
[Flacon* 25 000 UI/ml]Seringue préremplie correspondante
[25 000 UI/ml]40-42 0,32 43-47 0,36 48-52 0,40 Seringue préremplie 10 000 53-56 0,44 57-59 0,47 60-64 0,50 Seringue préremplie 12 500 65-68 0,53 69-72 0,56 73-77 0,60 Seringue préremplie 15 000 78-82 0,64 83-87 0,68 >= 88 0,72** Seringue préremplie 18 000**
* Non disponible à la date du 15.02.2011.
** Cette posologie maximale de 0,72 ml (18 000 UI) a été utilisée chez des patients pesant jusqu'à 132 kg dans l'étude CLOT.
- Dose administrée :
- Coût du traitement journalier : 10,43 euro(s) (15 000 UI/0,6 ml) à 12,49 euro(s) (18 000 UI/0,72 ml).
-
- Prévention des récidives des événements thromboemboliques veineux du 2e au 6e mois suivant l'événement :
-
- Solutions injectables à 7500 UI anti-Xa/0,3 ml, à 10 000 UI anti-Xa/0,4 ml, à 12 500 UI anti-Xa/0,5 ml, à 15 000 UI anti-Xa/0,6 ml et à 18 000 UI anti-Xa/0,72 ml :
-
- Fréquence d'administration :
1 seule injection par jour.
- Fréquence d'administration :
-
- Dose administrée :
La dose par injection est de 150 UI anti-Xa/kg. La dose maximale quotidienne ne doit pas excéder 18 000 UI. Les seringues préremplies seront utilisées à l'aide du tableau ci-dessous.
Une surveillance régulière du poids des patients cancéreux est nécessaire pour ajuster le traitement en fonction d'un poids récent.Poids corporel
(kg)Dose de daltéparine recommandée
(UI/j)
[Seringue préremplie à 25 000 UI/ml]40-56 7500 UI dans 0,3 ml 57-68 10 000 UI dans 0,4 ml 69-82 12 500 UI dans 0,5 ml 83-98 15 000 UI dans 0,6 ml > 99 18 000 UI dans 0,72 ml
- Dose administrée :
- Coût du traitement journalier : 8,69 euro(s) (12 500 UI/0,5 ml) à 10,43 euro(s) (15 000 UI/0,6 ml).
-
- Durée du traitement :
La durée recommandée est de 6 mois. L'intérêt de poursuivre le traitement au-delà de cette période sera évalué en fonction du rapport bénéfice/risque individuel, en prenant notamment en compte l'évolutivité du cancer. Si le traitement anticoagulant doit être poursuivi, aucune donnée n'étant disponible avec la daltéparine au-delà de 6 mois de traitement, un relais par les antagonistes de la vitamine K sera envisagé selon les règles usuelles de prescription (cf Mises en garde et Précautions d'emploi).
- Durée du traitement :
- Recommandation en cas de thrombopénie survenant sous traitement :
-
- Solutions injectables à 7500 UI anti-Xa/0,3 ml, à 10 000 UI anti-Xa/0,4 ml, à 12 500 UI anti-Xa/0,5 ml, à 15 000 UI anti-Xa/0,6 ml et à 18 000 UI anti-Xa/0,72 ml :
- En cas de thrombopénie induite par la chimiothérapie, la posologie de daltéparine sera adaptée selon la stratégie suivante :
- en cas de plaquettes < 50 000/mm3, le traitement doit être interrompu jusqu'à ce que celles-ci reviennent au dessus de 50 000/mm3 ;
- en cas de plaquettes comprises entre 50 et 100 000/mm3, la posologie initialement recommandée doit être réduite selon le tableau ci-dessous. Une fois les plaquettes revenues au-dessus de 100 000/mm3, le traitement sera repris selon les posologies définies au préalable.
Dose de daltéparine prévue (UI/j) Dose réduite de daltéparine (UI/j) en cas de thrombopénie 7500 5000 10 000 7500 12 500 10 000 15 000 12 500 18 000 15 000
- en cas de plaquettes < 50 000/mm3, le traitement doit être interrompu jusqu'à ce que celles-ci reviennent au dessus de 50 000/mm3 ;
- Populations particulières :
-
- Insuffisance rénale :
-
- Clairance de la créatinine <= 30 ml/min selon l'estimation de la formule de Cockcroft : en l'absence de données, ce médicament est contre-indiqué (cf Contre-indications), à l'exception de l'administration au cours de l'hémodialyse.
- Clairance de la créatinine comprise entre 30 et 60 ml/min selon l'estimation de la formule de Cockcroft : dans cette situation, la dose de daltéparine doit être adaptée en tenant compte de l'activité anti-Xa (cf Mises en garde et Précautions d'emploi).
- Clairance de la créatinine <= 30 ml/min selon l'estimation de la formule de Cockcroft : en l'absence de données, ce médicament est contre-indiqué (cf Contre-indications), à l'exception de l'administration au cours de l'hémodialyse.
-
- Enfant :
- Il n'y a pas d'expérience chez l'enfant. Par conséquent, ce médicament ne doit pas être utilisé chez l'enfant (cf Mises en garde et Précautions d'emploi).
CONTRE-INDICATIONS |
- Absolues :
-
Quelles que soient les doses (curatives ou préventives) :
- Hypersensibilité à la daltéparine ou à l'un des excipients.
- Antécédents de thrombopénie induite par l'héparine (ou TIH) grave de type II sous héparine non fractionnée ou sous héparine de bas poids moléculaire (cf Mises en garde et Précautions d'emploi).
- Manifestations ou tendances hémorragiques liées à des troubles de l'hémostase (les coagulations intravasculaires disséminées peuvent être une exception à cette règle, lorsqu'elles ne sont pas liées à un traitement par l'héparine ; cf Mises en garde et Précautions d'emploi).
- Lésion organique susceptible de saigner.
- Sujet pesant <= 40 kg, en l'absence de données (solutions injectables à 7500 UI anti-Xa/0,3 ml, à 10 000 UI anti-Xa/0,4 ml, à 12 500 UI anti-Xa/0,5 ml, à 15 000 UI anti-Xa/0,6 ml et à 18 000 UI anti-Xa/0,72 ml).
- Hypersensibilité à la daltéparine ou à l'un des excipients.
-
A doses curatives :
- Hémorragie intracérébrale.
- Insuffisance rénale sévère : en l'absence de données, en cas de clairance de la créatinine <= 30 ml/min selon l'estimation de la formule de Cockcroft, à l'exception de l'administration au cours de l'hémodialyse. Pour le calcul de la formule de Cockcroft, il est nécessaire de disposer d'un poids récent du patient (cf Mises en garde et Précautions d'emploi).
- Une anesthésie péridurale ou une rachianesthésie ne doivent jamais être effectuées lors d'un traitement curatif par HBPM.
- Hémorragie intracérébrale.
- Relatives :
-
- Femme enceinte (cf Fertilité/Grossesse/Allaitement).
- Femme enceinte (cf Fertilité/Grossesse/Allaitement).
-
A doses curatives :
- Accident vasculaire cérébral ischémique étendu à la phase aiguë, avec ou sans troubles de la conscience. Lorsque l'accident vasculaire cérébral est d'origine embolique, le délai à respecter est de 72 heures. La preuve de l'efficacité des HBPM à dose curative n'a cependant pas été établie à ce jour, quelles que soient la cause, l'étendue et la sévérité clinique de l'infarctus cérébral.
- Endocardite infectieuse aiguë (en dehors de certaines cardiopathies emboligènes).
- Insuffisance rénale légère à modérée (clairance de la créatinine > 30 et < 60 ml/min).
- Tous les sujets, quel que soit l'âge, en association avec : acide acétylsalicylique aux doses antalgiques, antipyrétiques et anti-inflammatoires ; AINS (voie générale) ; dextran 40 (voie parentérale), cf Interactions.
- Accident vasculaire cérébral ischémique étendu à la phase aiguë, avec ou sans troubles de la conscience. Lorsque l'accident vasculaire cérébral est d'origine embolique, le délai à respecter est de 72 heures. La preuve de l'efficacité des HBPM à dose curative n'a cependant pas été établie à ce jour, quelles que soient la cause, l'étendue et la sévérité clinique de l'infarctus cérébral.
-
A doses préventives (solutions injectables à 2500 UI anti-Xa/0,2 ml, à 5000 UI anti-Xa/0,2 ml, à 7500 UI anti-Xa/0,75 ml et à 10 000 UI anti-Xa/1 ml) :
- Insuffisance rénale sévère (clairance de la créatinine de l'ordre de 30 ml/min selon l'estimation de la formule de Cockcroft : cf Mises en garde et Précautions d'emploi).
- Dans les 24 premières heures qui suivent une hémorragie intracérébrale.
- Sujet âgé de plus de 65 ans, en association avec : acide acétylsalicylique aux doses antalgiques, antipyrétiques et anti-inflammatoires ; AINS (voie générale) ; dextran 40 (voie parentérale), cf Interactions.
- Insuffisance rénale sévère (clairance de la créatinine de l'ordre de 30 ml/min selon l'estimation de la formule de Cockcroft : cf Mises en garde et Précautions d'emploi).
MISES EN GARDE et PRÉCAUTIONS D'EMPLOI |
- Risque hémorragique :
- Il est impératif de respecter les schémas thérapeutiques recommandés (posologies et durées de traitement). Dans le cas contraire, des accidents hémorragiques peuvent s'observer, surtout chez les sujets à risque (sujets âgés, insuffisants rénaux...).
- Les accidents hémorragiques graves ont notamment été observés :
- chez le sujet âgé, notamment du fait de la détérioration de la fonction rénale liée à l'âge ;
- en cas d'insuffisance rénale ;
- en cas de poids inférieur à 40 kg ;
- en cas de traitement prolongé au-delà de la durée moyenne préconisée de 10 jours ;
- en cas de non-respect des modalités thérapeutiques conseillées (notamment durées de traitement et adaptation de la dose en fonction du poids pour les traitements curatifs) ;
- en cas d'association à des médicaments majorant le risque hémorragique (cf Interactions).
- chez le sujet âgé, notamment du fait de la détérioration de la fonction rénale liée à l'âge ;
- Dans tous les cas, une surveillance particulière est indispensable chez les patients âgés et/ou insuffisants rénaux, ainsi qu'en cas de traitement prolongé au-delà de 10 jours.
- Pour détecter une accumulation, une mesure de l'activité anti-Xa peut être utile dans certains cas (cf Précautions d'emploi : surveillance biologique).
- Risque de thrombopénie induite par l'héparine (TIH) :
- Devant un patient traité par HBPM (à dose curative ou préventive) qui présente un événement thrombotique, tel que :
- une aggravation de la thrombose pour laquelle il est traité,
- une phlébite,
- une embolie pulmonaire,
- une ischémie aiguë des membres inférieurs,
- voire un infarctus du myocarde ou un accident vasculaire cérébral ischémique,
- une aggravation de la thrombose pour laquelle il est traité,
- il faut systématiquement penser à une thrombopénie induite par l'héparine (TIH) et faire pratiquer en urgence une numération des plaquettes (cf Précautions d'emploi).
- Utilisation chez l'enfant :
- En l'absence de données, l'utilisation des HBPM chez l'enfant n'est pas recommandée.
Avant d'instaurer un traitement par HBPM, il est indispensable d'évaluer la fonction rénale, et plus particulièrement chez le sujet âgé à partir de 75 ans, en calculant la clairance de la créatinine (Clcr) à l'aide de la formule de Cockcroft en disposant d'un poids récent du patient :
Chez l'homme : Clcr = [ (140 - âge) × poids ] / [ (0,814 × créatininémie) ]
avec l'âge exprimé en années, le poids en kg, la créatininémie en µmol/l.
Cette formule doit être corrigée pour les femmes en multipliant le résultat par 0,85.
Lorsque la créatinine est exprimée en mg/ml, multiplier par un facteur 8,8.
La mise en évidence d'une insuffisance rénale sévère (Clcr de l'ordre de 30 ml/min) contre-indique la prescription d'HBPM dans les indications curatives (cf Contre-indications).
- Surveillance plaquettaire des patients sous HBPM et risque de Thrombopénie induite par l'héparine (ou TIH de type II) :
-
- Les HBPM peuvent induire des TIH de type II, thrombopénies graves d'origine immunologique, responsables d'accidents thromboemboliques artériels ou veineux pouvant menacer le pronostic vital ou fonctionnel des patients (cf Effets indésirables). Afin de pouvoir détecter les TIH de manière optimale, il est nécessaire de surveiller les patients de la manière suivante :
- Dans un contexte chirurgical ou traumatique récent (dans les 3 mois) :
- Une surveillance biologique systématique est nécessaire, que l'indication du traitement soit préventive ou curative, chez tous les patients, compte tenu de l'incidence des TIH > 0,1 %, voire > 1 %, en chirurgie et en traumatologie. Elle consiste à pratiquer une numération plaquettaire :
- avant le traitement par HBPM ou au plus tard dans les 24 heures après l'instauration du traitement,
- puis 2 fois par semaine pendant un mois (période de risque maximal),
- puis une fois par semaine jusqu'à l'arrêt du traitement en cas de traitement prolongé.
- avant le traitement par HBPM ou au plus tard dans les 24 heures après l'instauration du traitement,
- Une surveillance biologique systématique est nécessaire, que l'indication du traitement soit préventive ou curative, chez tous les patients, compte tenu de l'incidence des TIH > 0,1 %, voire > 1 %, en chirurgie et en traumatologie. Elle consiste à pratiquer une numération plaquettaire :
- En dehors d'un contexte chirurgical ou traumatique récent (dans les 3 mois) :
- Une surveillance biologique systématique est nécessaire, que l'indication du traitement soit préventive ou curative, selon les mêmes modalités qu'en chirurgie et en traumatologie (cf ci-dessus) chez les patients :
- ayant des antécédents d'exposition à l'HNF ou aux HBPM dans les 6 derniers mois, compte tenu de l'incidence des TIH > 0,1 %, voire > 1 %,
- atteints de comorbidités importantes, compte tenu de la gravité potentielle des TIH chez ces patients.
- ayant des antécédents d'exposition à l'HNF ou aux HBPM dans les 6 derniers mois, compte tenu de l'incidence des TIH > 0,1 %, voire > 1 %,
- Dans les autres cas, compte tenu de l'incidence des TIH plus faible (< 0,1 %), la surveillance de la numération plaquettaire peut être réduite à :
- une seule numération plaquettaire en début de traitement ou au plus tard dans les 24 heures après l'instauration du traitement,
- une numération plaquettaire en cas de manifestation clinique évocatrice de TIH (tout nouvel épisode thromboembolique artériel et/ou veineux, toute lésion cutanée douloureuse au site d'injection, toute manifestation allergique ou anaphylactoïde sous traitement). Le patient doit être informé de la possibilité de survenue de ces manifestations et de la nécessité de prévenir son médecin référent le cas échéant.
- une seule numération plaquettaire en début de traitement ou au plus tard dans les 24 heures après l'instauration du traitement,
- Une surveillance biologique systématique est nécessaire, que l'indication du traitement soit préventive ou curative, selon les mêmes modalités qu'en chirurgie et en traumatologie (cf ci-dessus) chez les patients :
- Dans un contexte chirurgical ou traumatique récent (dans les 3 mois) :
- Une TIH doit être suspectée devant un nombre de plaquettes < 150 000/mm3 (ou 150 giga/l) et/ou une chute relative des plaquettes de 50 %, voire 30 %, par rapport à la numération plaquettaire avant tout traitement. Elle apparaît essentiellement entre le 5e et le 21e jour suivant l'instauration du traitement héparinique (avec un pic de fréquence aux environs du 10e jour).
Mais elle peut survenir beaucoup plus précocement, lorsque des antécédents de thrombopénie sous héparine existent, et des cas isolés ont été rapportés au-delà de 21 jours. De tels antécédents seront donc systématiquement recherchés au cours d'un interrogatoire approfondi avant le début du traitement.
Dans tous les cas, l'apparition d'une TIH constitue une situation d'urgence et nécessite un avis spécialisé.
Toute baisse significative (30 à 50 % de la valeur initiale) de la numération plaquettaire doit donner l'alerte, avant même que cette valeur n'atteigne un seuil critique. La constatation d'une diminution du nombre des plaquettes impose dans tous les cas :- Un contrôle immédiat de la numération.
- La suspension du traitement héparinique, si la baisse est confirmée, voire accentuée lors de ce contrôle, en l'absence d'une autre étiologie évidente.
Un prélèvement doit être réalisé sur tube citraté pour réaliser des tests d'agrégation plaquettaire in vitro et des tests immunologiques. Mais, dans ces conditions, la conduite à tenir immédiate ne repose pas sur le résultat de ces tests d'agrégation plaquettaire in vitro ou immunologiques, car seuls quelques laboratoires spécialisés les pratiquent en routine et le résultat n'est obtenu, dans le meilleur des cas, qu'au bout de plusieurs heures. Ces tests doivent cependant être réalisés pour aider au diagnostic de cette complication, car en cas de poursuite du traitement héparinique, le risque de thrombose est majeur.
- La prévention ou le traitement des complications thrombotiques de la TIH.
Si la poursuite de l'anticoagulation semble indispensable, l'héparine doit être relayée par une autre classe d'antithrombotiques : danaparoïde sodique ou lépirudine, prescrits suivant les cas à dose préventive ou curative.
Le relais par les AVK ne sera pris qu'après normalisation de la numération plaquettaire, en raison du risque d'aggravation du phénomène thrombotique par les AVK.
- Un contrôle immédiat de la numération.
- Les HBPM peuvent induire des TIH de type II, thrombopénies graves d'origine immunologique, responsables d'accidents thromboemboliques artériels ou veineux pouvant menacer le pronostic vital ou fonctionnel des patients (cf Effets indésirables). Afin de pouvoir détecter les TIH de manière optimale, il est nécessaire de surveiller les patients de la manière suivante :
- Relais de l'héparine par les AVK :
- Renforcer alors la surveillance clinique et biologique (temps de Quick exprimé en INR) pour contrôler l'effet des AVK.
- En raison du temps de latence précédant le plein effet de l'antivitamine K utilisé, l'héparine doit être maintenue à dose équivalente pendant toute la durée nécessaire pour que l'INR soit dans la zone thérapeutique souhaitable de l'indication lors de deux contrôles successifs.
- Contrôle de l'activité anti-Xa :
- La majorité des études cliniques qui ont démontré l'efficacité des HBPM ayant été conduites avec une dose adaptée au poids et sans surveillance biologique particulière, l'utilité d'une surveillance biologique n'a pas été établie pour apprécier l'efficacité d'un traitement par HBPM. Toutefois, la surveillance biologique par détermination de l'activité anti-Xa peut être utile pour gérer le risque hémorragique, dans certaines situations cliniques fréquemment associées à un risque de surdosage.
- Ces situations concernent essentiellement les indications curatives des HBPM, en raison des doses administrées, quand existent :
-
- Une insuffisance rénale légère à modérée (clairance estimée selon la formule de Cockcroft de l'ordre de 30 ml/min à 60 ml/min) : en effet, contrairement à l'héparine standard non fractionnée, les HBPM s'éliminent en grande partie par le rein et toute insuffisance rénale peut conduire à un surdosage relatif.
L'insuffisance rénale sévère constitue, quant à elle, une contre-indication à l'utilisation des HBPM aux doses curatives (cf Contre-indications).
- Un poids extrême (maigreur, voire cachexie, obésité).
- Une hémorragie inexpliquée.
- Une insuffisance rénale légère à modérée (clairance estimée selon la formule de Cockcroft de l'ordre de 30 ml/min à 60 ml/min) : en effet, contrairement à l'héparine standard non fractionnée, les HBPM s'éliminent en grande partie par le rein et toute insuffisance rénale peut conduire à un surdosage relatif.
- A l'inverse, la surveillance biologique n'est pas recommandée aux doses prophylactiques si le traitement par HBPM est conforme aux modalités thérapeutiques conseillées (en particulier pour la durée de traitement), ainsi qu'au cours de l'hémodialyse.
- Afin de détecter une possible accumulation après plusieurs administrations, il est, le cas échéant, recommandé de prélever le sang du patient au pic maximal d'activité (selon les données disponibles), c'est-à-dire environ 4 heures après la 3e administration, lorsque le médicament est délivré en 2 injections SC par jour.
- La répétition du dosage de l'activité anti-Xa pour mesurer l'héparinémie, par exemple tous les 2 à 3 jours, sera discutée au cas par cas, en fonction des résultats du dosage précédent, et une éventuelle modification de la dose d'HBPM sera envisagée.
- Pour chaque HBPM et chaque schéma thérapeutique, l'activité anti-Xa générée est différente.
- A titre indicatif, d'après les données disponibles, la moyenne observée (± écart-type) à la 4e heure pour la daltéparine sodique délivrée à la dose de 100 UI anti-Xa/kg en 2 injections par 24 heures a été de 0,59 ± 0,25 ; 0,60 ± 0,21 ; 0,62 ± 0,22 ; 0,67 ± 0,21 ; 0,69 ± 0,26 UI anti-Xa, respectivement au jour 2, 4, 6, 8 et 10 du traitement.
- Ces valeurs moyennes ont été observées au cours des essais cliniques pour les dosages d'activité anti-Xa effectués par méthode chromogénique (amidolytique).
- Temps de céphaline avec activateur (TCA) :
- Certaines HBPM allongent modérément le TCA. En l'absence de pertinence clinique établie, toute surveillance du traitement fondée sur ce test est inutile.
- Comme avec les autres anticoagulants, de rares cas d'hématomes intrarachidiens entraînant une paralysie prolongée ou permanente ont été rapportés lors de l'administration d'HBPM au décours d'une rachianesthésie ou d'une anesthésie péridurale.
Le risque d'hématome intrarachidien paraît plus important avec la péridurale avec cathéter qu'avec la rachianesthésie.
Le risque de ces événements rares peut être augmenté par l'utilisation postopératoire prolongée de cathéters périduraux.
- Si un traitement préopératoire par HBPM est nécessaire (alitement prolongé, traumatisme) et que le bénéfice d'une anesthésie locorégionale rachidienne a été soigneusement évalué, cette technique pourra être utilisée chez un patient ayant reçu une injection préopératoire d'HBPM, à condition de respecter un délai d'au moins 12 heures entre l'injection d'héparine et la réalisation de l'anesthésie rachidienne. Une surveillance neurologique attentive est recommandée, en raison du risque d'hématome intrarachidien.
Dans la quasi-totalité des cas, le traitement prophylactique par HBPM pourra être débuté dans les 6 à 8 heures qui suivent la réalisation de la technique ou l'ablation du cathéter, sous couvert d'une surveillance neurologique.
Une attention particulière sera portée en cas d'association avec d'autres médicaments interférant avec l'hémostase (notamment anti-inflammatoires non stéroïdiens, aspirine).
- insuffisance hépatique,
- antécédents d'ulcères digestifs ou de toute autre lésion organique susceptible de saigner,
- maladies vasculaires de la choriorétine,
- en période postopératoire après chirurgie du cerveau et de la moelle épinière,
- la réalisation d'une ponction lombaire devra être discutée en tenant compte du risque de saignement intrarachidien. Elle devra être différée chaque fois que possible.
INTERACTIONS |
Certains médicaments ou classes thérapeutiques sont susceptibles de favoriser la survenue d'une hyperkaliémie : les sels de potassium, les diurétiques hyperkaliémiants, les inhibiteurs de l'enzyme de conversion, les inhibiteurs de l'angiotensine II, les anti-inflammatoires non stéroïdiens, les héparines (de bas poids moléculaire ou non fractionnées), la ciclosporine et le tacrolimus, le triméthoprime.
La survenue d'une hyperkaliémie peut dépendre de l'existence de facteurs de risque associés.
Ce risque est majoré en cas d'association des médicaments sus-cités. Chez le sujet de moins de 65 ans aux doses curatives d'HBPM et chez le sujet de plus de 65 ans quelle que soit la dose d'HBPM :
Déconseillées :
- Acide acétylsalicylique aux doses antalgiques, antipyrétiques et anti-inflammatoires (et, par extrapolation, autres salicylés) : augmentation du risque hémorragique (inhibition de la fonction plaquettaire et agression de la muqueuse gastroduodénale par les salicylés). Utiliser un analgésique antipyrétique non salicylé (type paracétamol).
- AINS (voie générale) : augmentation du risque hémorragique (inhibition de la fonction plaquettaire et agression de la muqueuse gastroduodénale par les anti-inflammatoires non stéroïdiens). Si l'association ne peut être évitée, surveillance clinique étroite.
- Dextran 40 (voie parentérale) : augmentation du risque hémorragique (inhibition de la fonction plaquettaire par le dextran 40).
Nécessitant des précautions d'emploi :
- Anticoagulants oraux : potentialisation de l'action anticoagulante. Lors du relais de l'héparine par l'anticoagulant oral, renforcer la surveillance clinique.
A prendre en compte :
- Antiagrégants plaquettaires (autres que acide acétylsalicylique à doses antalgiques, antipyrétiques et anti-inflammatoires ; AINS) : abciximab, acide acétylsalicylique aux doses antiagrégantes dans les indications cardiologiques et neurologiques, béraprost, clopidogrel, eptifibatide, iloprost, ticlopidine, tirofiban : augmentation du risque hémorragique.
Chez le sujet de moins de 65 ans aux doses préventives d'HBPM (solutions injectables à 2500 UI anti-Xa/0,2 ml, à 5000 UI anti-Xa/0,2 ml, à 7500 UI anti-Xa/0,75 ml et à 10 000 UI anti-Xa/1 ml) :
A prendre en compte :
L'utilisation conjointe de médicaments agissant à divers niveaux de l'hémostase majore le risque de saignement. Ainsi, quel que soit l'âge, l'association des HBPM à doses préventives aux anticoagulants oraux, aux antiagrégants plaquettaires (abciximab, AINS, acide acétylsalicylique quelle que soit la dose, clopidogrel, eptifibatide, iloprost, ticlopidine, tirofiban) et aux thrombolytiques doit être prise en compte en maintenant une surveillance clinique et éventuellement biologique.
FERTILITÉ/GROSSESSE/ALLAITEMENT |
Les études effectuées chez l'animal n'ont pas mis en évidence d'effet tératogène de la daltéparine sodique.
En l'absence d'effet tératogène chez l'animal, un effet malformatif dans l'espèce humaine n'est pas attendu. En effet, à ce jour, les substances responsables de malformations dans l'espèce humaine se sont révélées tératogènes chez l'animal au cours d'études bien conduites sur deux espèces.
- Traitement préventif au 1er trimestre et traitement curatif :
- En clinique, il n'existe pas actuellement de données suffisamment pertinentes pour évaluer un éventuel effet malformatif ou foetotoxique de la daltéparine lorsqu'elle est administrée à dose préventive pendant le 1er trimestre de la grossesse ou à dose curative pendant toute la grossesse.
- En conséquence, par mesure de précaution, il est préférable de ne pas utiliser la daltéparine à dose préventive pendant le 1er trimestre de la grossesse ou à dose curative pendant toute la grossesse.
- Traitement préventif au cours des 2e et 3e trimestres :
- En clinique, l'utilisation de la daltéparine au cours d'un nombre limité de grossesses, au cours des 2e et 3e trimestres, n'a apparemment révélé aucun effet malformatif ou foetotoxique particulier à ce jour. Toutefois, des études complémentaires sont nécessaires pour évaluer les conséquences d'une exposition dans ces conditions.
- En conséquence, l'utilisation de la daltéparine à dose préventive au cours des 2e et 3e trimestres ne doit être envisagée au cours de la grossesse que si nécessaire.
Si une anesthésie péridurale est envisagée, il convient, dans la mesure du possible, de suspendre le traitement héparinique, au plus tard dans les 12 heures qui précèdent l'anesthésie, pour un traitement préventif.
Allaitement :
Le passage de la daltéparine dans le lait est faible.
La résorption digestive chez le nouveau-né est a priori improbable.
Le traitement par la daltéparine sodique est compatible avec l'allaitement.
CONDUITE et UTILISATION DE MACHINES |
EFFETS INDÉSIRABLES |
- Manifestations hémorragiques ; elles surviennent essentiellement en présence de :
- facteurs de risque associés : lésions organiques susceptibles de saigner, certaines associations médicamenteuses (cf Contre-indications, Interactions), âge, insuffisance rénale, faible poids ;
- non-respect des modalités thérapeutiques, notamment durée de traitement et adaptation de la dose en fonction du poids (cf Mises en garde et Précautions d'emploi : risque hémorragique).
Ces événements ont entraîné des lésions neurologiques de gravité variable, dont des paralysies prolongées ou permanentes (cf Mises en garde et Précautions d'emploi).
- facteurs de risque associés : lésions organiques susceptibles de saigner, certaines associations médicamenteuses (cf Contre-indications, Interactions), âge, insuffisance rénale, faible poids ;
- Des hémorragies rétropéritonéales et intracrâniennes ont été rapportées à une fréquence inconnue, certaines étant fatales.
- L'administration par voie sous-cutanée peut entraîner la survenue d'hématomes aux points d'injection. Ils sont majorés par le non-respect de la technique d'injection ou l'utilisation d'un matériel d'injection inadéquat. Des nodules fermes disparaissant en quelques jours traduisent un processus inflammatoire et ne sont pas un motif d'arrêt du traitement.
- Des thrombopénies ont été rapportées. Elles sont de deux types :
- les plus fréquentes, de type I, sont habituellement modérées (> 100 000/mm3), précoces (avant le 5e jour) et ne nécessitent pas l'arrêt du traitement ;
- rarement, des thrombopénies immuno-allergiques graves de type II (TIH). Leur prévalence est encore mal évaluée (cf Mises en garde et Précautions d'emploi).
- les plus fréquentes, de type I, sont habituellement modérées (> 100 000/mm3), précoces (avant le 5e jour) et ne nécessitent pas l'arrêt du traitement ;
- Possibilité d'élévation asymptomatique et réversible des plaquettes.
- De rares nécroses cutanées au point d'injection ont été signalées avec les héparines. Ces réactions peuvent être précédées d'un purpura ou de placards érythémateux, infiltrés et douloureux. La suspension du traitement doit être immédiate.
- Des cas d'alopécie de fréquence inconnue.
- Rares manifestations allergiques cutanées ou générales susceptibles, dans certains cas, de conduire à l'arrêt du médicament.
- Le risque d'ostéoporose ne peut être exclu, comme avec les héparines non fractionnées, en cas de traitement prolongé.
- Élévation transitoire des transaminases.
- Quelques cas d'hyperkaliémie.
SURDOSAGE |
En cas d'hémorragie, un traitement par sulfate de protamine peut être indiqué dans certains cas, en tenant compte des faits suivants :
- son efficacité est nettement inférieure à celle rapportée lors d'un surdosage par l'héparine non fractionnée ;
- en raison de ses effets indésirables (notamment choc anaphylactique), le rapport bénéfice/risque du sulfate de protamine sera soigneusement évalué avant prescription.
La dose de protamine utile est fonction :
- de la dose d'héparine injectée (on peut utiliser 100 UAH de protamine pour neutraliser l'activité de 100 UI anti-Xa d'héparine de bas poids moléculaire) ;
- du temps écoulé depuis l'injection de l'héparine, avec éventuellement une réduction des doses de l'antidote.
Par ailleurs, la cinétique de résorption de l'héparine de bas poids moléculaire peut rendre cette neutralisation transitoire, et nécessiter de fragmenter la dose totale calculée de protamine en plusieurs injections (2 à 4) réparties sur 24 heures.
En cas d'ingestion, même massive, d'héparine de bas poids moléculaire (aucun cas rapporté), aucune conséquence grave n'est, a priori, à redouter, compte tenu de la très faible résorption du produit aux niveaux gastrique et intestinal.
PHARMACODYNAMIE |
Classe pharmacothérapeutique : Antithrombotiques (code ATC : B01AB04).
- La daltéparine est une héparine de bas poids moléculaire dans laquelle les activités antithrombotique et anticoagulante de l'héparine standard ont été dissociées.
Elle est caractérisée par une activité anti-Xa plus élevée que l'activité anti-IIa ou antithrombinique. Pour la daltéparine, le rapport entre ces deux activités est de 2,5.
- Aux doses prophylactiques, la daltéparine n'entraîne pas de modification notable du TCA.
- Aux doses curatives, au pic maximum d'activité, le TCA peut être allongé de 1,4 fois le temps du témoin. Cet allongement est le reflet de l'activité antithrombotique résiduelle de la daltéparine.
- Traitement prophylactique de la maladie thromboembolique veineuse chez des patients alités pour une affection médicale aiguë (solution injectable à 5000 UI anti-Xa/0,2 ml) :
- Une étude randomisée (Prevent) en double insu comparant l'efficacité et la tolérance de la daltéparine 5000 UI anti-Xa/0,2 ml à un placebo administrés une fois par jour, par voie sous-cutanée, pendant 12 à 14 jours dans la prophylaxie de la maladie thromboembolique veineuse a été réalisée chez 3706 patients à risque thromboembolique veineux considéré comme modéré, alités pour une affection médicale aiguë depuis 3 jours au plus. Ces patients âgés de plus de 40 ans présentaient une insuffisance cardiaque (classe NYHA III ou IV), une insuffisance respiratoire aiguë, une maladie infectieuse ou rhumatologique aiguë associée à au moins un autre facteur de risque thromboembolique veineux (âge >= 75 ans, cancer, antécédents thromboemboliques veineux, obésité, varices veineuses, traitement hormonal, insuffisance cardiaque ou respiratoire chronique, syndrome myéloprolifératif).
- Les patients médicaux à haut risque de complication thromboembolique veineuse (infarctus du myocarde à la phase aiguë, pathologie cardiaque nécessitant un traitement anticoagulant comme une arythmie ou une pathologie valvulaire, patients intubés ou ayant fait un accident vasculaire cérébral dans les 3 mois) n'ont pas été inclus dans l'étude.
- Le critère principal d'efficacité était l'incidence des événements thromboemboliques veineux cliniquement significatifs évalués jusqu'au 21e jour (+ 3) et définis par la survenue :
- d'une thrombose veineuse profonde (TVP) symptomatique, proximale ou distale, confirmée par échographie Doppler (et phlébographie si nécessaire) ;
- d'une embolie pulmonaire (EP) symptomatique fatale ou non fatale, confirmée par scintigraphie de ventilation-perfusion, angiographie, tomographie, IRM ou autopsie ;
- d'une TVP proximale asymptomatique documentée par échographie Doppler (et phlébographie si nécessaire) ;
- ou d'un décès subit.
- d'une thrombose veineuse profonde (TVP) symptomatique, proximale ou distale, confirmée par échographie Doppler (et phlébographie si nécessaire) ;
- L'incidence des événements thromboemboliques veineux était de 2,77 % (42/1518) dans le groupe daltéparine par rapport à 4,96 % (73/1473) dans le groupe placebo (différence : - 2,19 ; IC : - 3,57 à - 0,81 ; p = 0,0015), soit une réduction du risque de 45 %.
- Sur le plan de la tolérance, la fréquence des hémorragies majeures comme mineures était faible :
- hémorragies majeures : 0,49 % (9/1849) dans le groupe daltéparine par rapport à 0,16 % (3/1833) dans le groupe placebo (RR : 2,98) ;
- hémorragies mineures : 1,03 % (19/1849) dans le groupe daltéparine par rapport à 0,55 % (10/1833) dans le groupe placebo (RR : 1,88 ; IC : 0,88 à 4,04).
- hémorragies majeures : 0,49 % (9/1849) dans le groupe daltéparine par rapport à 0,16 % (3/1833) dans le groupe placebo (RR : 2,98) ;
- Étude CLOT dans la prise en charge au long cours de la maladie thromboembolique veineuse chez les patients cancéreux (solutions injectables à 7500 UI anti-Xa/0,3 ml, à 10 000 UI anti-Xa/0,4 ml, à 12 500 UI anti-Xa/0,5 ml, à 15 000 UI anti-Xa/0,6 ml et à 18 000 UI anti-Xa/0,72 ml) :
- CLOT est une étude randomisée, multicentrique, ouverte qui a comparé un traitement par la daltéparine à un traitement anticoagulant standard chez 676 patients ayant un cancer actif et présentant un événement thromboembolique aigu symptomatique (thrombose veineuse profonde [TVP] et/ou embolie pulmonaire [EP]).
- Les patients étaient randomisés dans l'un de ces deux groupes :
- le groupe daltéparine, prescrite à la posologie de 200 UI/kg/j en une injection sous-cutanée (SC) [maximum : 18 000 UI/j) pendant 1 mois, puis 150 UI/kg/j du 2e au 6e mois, ou
- le groupe antivitamine K (AVK), prescrit pendant 6 mois (avec INR cible 2-3), précédé d'un traitement par la daltéparine à la dose de 200 UI/kg/j en une injection SC (maximum 18 000 UI/j) pendant 5 à 7 jours.
- le groupe daltéparine, prescrite à la posologie de 200 UI/kg/j en une injection sous-cutanée (SC) [maximum : 18 000 UI/j) pendant 1 mois, puis 150 UI/kg/j du 2e au 6e mois, ou
- Les cancers le plus fréquemment diagnostiqués étaient gastro-intestinaux et pancréatiques (23,7 %), génito-urinaires - prostate, testicules, ovaires, col utérin, endomètre et vessie - (21,5 %), sein (16,0 %), poumon (13,3 %). 10,4 % des patients avaient un cancer hématologique ; 75,1 % des patients présentaient des métastases. L'événement thromboembolique initial était une TVP isolée dans près de 70 % des cas et une EP avec ou sans TVP dans 30 % des cas.
- Le critère principal était le délai de survenue de la première récidive thromboembolique symptomatique (TVP et/ou EP) dans les 6 mois.
- Un total de 27 patients sur 338 (8 %) dans le groupe daltéparine et 53 patients sur 338 (15,7 %) dans le groupe AVK ont présenté au moins un des événements du critère principal. Une réduction significative de 52 % à 6 mois du risque de récidive d'événement thromboembolique a été observée dans le groupe daltéparine (RR = 0,48, IC 95 % [0,30-0,77], p = 0,0016).
- Dans le groupe daltéparine, 19 patients (5,6 %) ont présenté au moins un épisode d'hémorragie majeure comparé à 12 patients dans le groupe AVK (3,6 %). La probabilité cumulative de survenue d'un épisode d'hémorragie majeure à 6 mois était respectivement de 6,5 % et 4,9 %.
- Il n'y a pas eu de différence significative entre les deux groupes sur les taux de mortalité à 6 et 12 mois (38,8 % versus 40,9 % et 56,2 % versus 57,9 % dans les bras daltéparine et AVK respectivement).
PHARMACOCINÉTIQUE |
Les paramètres pharmacocinétiques sont étudiés à partir de l'évolution des activités anti-Xa plasmatiques.
- Biodisponibilité :
-
- Solutions injectables à 2500 UI anti-Xa/0,2 ml, à 5000 UI anti-Xa/0,2 ml, à 7500 UI anti-Xa/0,75 ml et à 10 000 UI anti-Xa/1 ml :
- Après injection par voie sous-cutanée, la résorption du produit est rapide et proche de 100 % ; l'activité plasmatique maximale est observée entre la 3e et la 4e heure si la daltéparine est administrée en 2 injections par jour. Ce pic est décalé entre la 4e et la 6e heure si la daltéparine est administrée en 1 injection par jour.
-
- Solutions injectables à 7500 UI anti-Xa/0,3 ml, à 10 000 UI anti-Xa/0,4 ml, à 12 500 UI anti-Xa/0,5 ml, à 15 000 UI anti-Xa/0,6 ml et à 18 000 UI anti-Xa/0,72 ml :
- Après injection par voie sous-cutanée, la résorption du produit est rapide et proche de 100 % ; l'activité plasmatique maximale est observée entre la 4e et la 6e heure si la dose de 200 UI/kg de daltéparine est administrée en 1 injection par jour.
- Métabolisme :
- Il s'effectue essentiellement au niveau hépatique (désulfatation, dépolymérisation).
- Distribution :
- Après injection par voie sous-cutanée, la demi-vie de l'activité anti-Xa est supérieure pour les héparines de bas poids moléculaire, comparativement aux héparines non fractionnées.
- Cette demi-vie est de l'ordre de 3 à 4 heures.
- Quant à l'activité anti-IIa, elle disparaît plus rapidement du plasma que l'activité anti-Xa avec les héparines de bas poids moléculaire.
- Élimination :
- L'élimination s'effectue principalement par voie rénale sous forme peu ou pas métabolisée.
- Populations à risque :
-
-
- Sujet âgé :
Chez le sujet âgé, la fonction rénale étant physiologiquement diminuée, l'élimination est ralentie. Cette modification n'a pas d'influence sur les doses et le rythme des injections en traitement préventif tant que la fonction rénale de ces patients reste dans des limites acceptables, c'est-à-dire faiblement altérée.
Il est indispensable d'évaluer systématiquement la fonction rénale des sujets âgés de plus de 75 ans par la formule de Cockcroft, avant l'instauration d'un traitement par HBPM (cf Mises en garde et Précautions d'emploi).
- Hémodialyse (solutions injectables à 2500 UI anti-Xa/0,2 ml, à 5000 UI anti-Xa/0,2 ml, à 7500 UI anti-Xa/0,75 ml et à 10 000 UI anti-Xa/1 ml) :
L'héparine de bas poids moléculaire est injectée dans la ligne artérielle du circuit de dialyse, à des doses suffisantes pour éviter la coagulation du circuit.
Les paramètres pharmacocinétiques ne sont, en principe, pas modifiés, sauf avec des doses importantes, où le passage dans la circulation générale peut donner lieu à une activité anti-Xa élevée, en rapport avec l'insuffisance rénale terminale.
- Insuffisance rénale légère à modérée (clairance de la créatinine > 30 ml/min) [solutions injectables à 7500 UI anti-Xa/0,3 ml, à 7500 UI anti-Xa/0,75 ml, à 10 000 UI anti-Xa/0,4 ml, à 10 000 UI anti-Xa/1 ml, à 12 500 UI anti-Xa/0,5 ml, à 15 000 UI anti-Xa/0,6 ml et à 18 000 UI anti-Xa/0,72 ml] : il peut être utile, dans certains cas, de contrôler l'activité anti-Xa circulante pour éliminer un surdosage dans les indications curatives (cf Mises en garde et Précautions d'emploi).
- Sujet âgé :
-
SÉCURITE PRÉCLINIQUE |
Les données non cliniques n'ont pas montré de risque particulier pour l'homme sur la base des études de toxicité après administrations répétées, de génotoxicité, de cancérogenèse et toxicité de la reproduction.
INCOMPATIBILITÉS |
En l'absence d'étude d'incompatibilité, ce médicament ne doit pas être mélangé avec d'autres médicaments.
MODALITÉS DE CONSERVATION |
- Durée de conservation :
- 3 ans.
- Solutions injectables à 2500 UI anti-Xa/0,2 ml, à 5000 UI anti-Xa/0,2 ml, à 7500 UI anti-Xa/0,75 ml et à 10 000 UI anti-Xa/1 ml : A conserver à une température ne dépassant pas 30 °C, dans son emballage jusqu'à utilisation.
- Solutions injectables à 7500 UI anti-Xa/0,3 ml, à 10 000 UI anti-Xa/0,4 ml, à 12 500 UI anti-Xa/0,5 ml, à 15 000 UI anti-Xa/0,6 ml et à 18 000 UI anti-Xa/0,72 ml : A conserver à une température ne dépassant pas 25 °C, dans l'emballage extérieur d'origine.
MODALITÉS MANIPULATION/ÉLIMINATION |
- Solutions injectables à 2500 UI anti-Xa/0,2 ml et à 5000 UI anti-Xa/0,2 ml :
-
- Utilisation du système de sécurité de l'aiguille :
- Le système de sécurité de l'aiguille consiste en un dispositif de sécurité en plastique rattaché à l'étiquette collée sur la seringue. Il est destiné à éviter les piqûres accidentelles après injection.
-
- Le système de sécurité nécessite pour être activé, les actions suivantes :
-
- Saisir le bout du système de sécurité en plastique et l'éloigner du capuchon protecteur de l'aiguille.
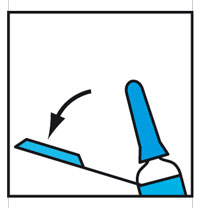
- Ôter le capuchon protecteur de l'aiguille.
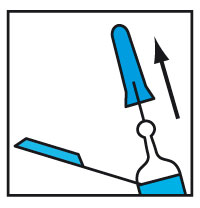
- Injecter selon le protocole habituel.
- Retirer l'aiguille du patient.
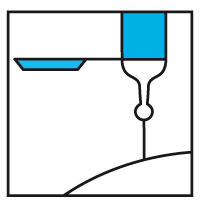
- Placer le système de sécurité de l'aiguille en plastique contre une surface dure et stable.
- Faire pivoter avec une main le corps de la seringue vers le haut de manière à introduire l'aiguille dans le dispositif : un clic audible confirme le verrouillage de l'aiguille.
- Plier l'aiguille jusqu'à ce que la seringue excède un angle de 45 degrés avec la surface plane pour la rendre inutilisable de manière irréversible.
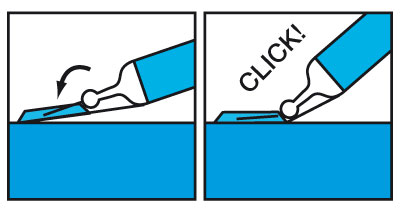
- Éliminer la seringue de manière appropriée.
- Saisir le bout du système de sécurité en plastique et l'éloigner du capuchon protecteur de l'aiguille.
- Tous dosages :
- Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| Fragmine 2500 UI anti-Xa/0,2 ml : | |
| AMM | 3400933010966 (1987) 2 seringues. |
| 3400933530129 (1992) 6 seringues. | |
| 3400955608448 (1988) 10 seringues. | |
| Fragmine 5000 UI anti-Xa/0,2 ml : | |
| AMM | 3400933010737 (1987) 2 seringues. |
| 3400933529819 (1992) 6 seringues. | |
| 3400955608509 (1988) 10 seringues. | |
| Fragmine 7500 UI anti-Xa/0,3 ml : | |
| AMM | 3400939743004 (2010) 10 seringues. |
| Fragmine 7500 UI anti-Xa/0,75 ml : | |
| AMM | 3400933730611 (1994) 2 seringues. |
| 3400934212970 (1994) 10 seringues. | |
| Fragmine 10 000 UI anti-Xa/0,4 ml : | |
| AMM | 3400949250196 (2010) 5 seringues. |
| Fragmine 10 000 UI anti-Xa/1 ml : | |
| AMM | 3400933730840 (1994) 2 seringues. |
| 3400934213052 (1994) 10 seringues. | |
| Fragmine 12 500 UI anti-Xa/0,5 ml : | |
| AMM | 3400939743233 (2010) 5 seringues. |
| Fragmine 15 000 UI anti-Xa/0,6 ml : | |
| AMM | 3400939743462 (2010) 5 seringues. |
| Fragmine 18 000 UI anti-Xa/0,72 ml : | |
| AMM | 3400939743523 (2010) 5 seringues. |
| RCP révisés le 22.03.2011. |
| Prix : | 6.87 euros (2 seringues 2500 UI/0,2 ml). |
| 19.53 euros (6 seringues 2500 UI/0,2 ml). | |
| 13.21 euros (2 seringues 5000 UI/0,2 ml). | |
| 37.57 euros (6 seringues 5000 UI/0,2 ml). | |
| 15.03 euros (2 seringues 7500 UI/0,75 ml). | |
| 66.98 euros (10 seringues 7500 UI/0,3 ml). | |
| 66.98 euros (10 seringues 7500 UI/0,75 ml). | |
| 44.43 euros (5 seringues 10 000 UI/0,4 ml). | |
| 18.93 euros (2 seringues 10 000 UI/1 ml). | |
| 83.63 euros (10 seringues 10 000 UI/1 ml). | |
| 56.69 euros (5 seringues 12 500 UI/0,5 ml). | |
| 66.98 euros (5 seringues 15 000 UI/0,6 ml). | |
| 79.33 euros (5 seringues 18 000 UI/0,72 ml). | |
| Remb Séc soc à 65 %. Collect. | |
| Modèles hospitaliers : Collect. | |
PFIZER
23-25, av du Dr-Lannelongue. 75014 Paris
Tél : 01 58 07 30 00
Info médic : Tél : 01 58 07 34 40
