TEMODAL®
témozolomide
FORMES et PRÉSENTATIONS |
Poudre pour solution pour perfusion IV à 2,5 mg/ml (blanche) : Flacon, boîte unitaire.
COMPOSITION |
| Gélule : | p gélule |
| Témozolomide (DCI) | 5 mg |
| ou | 20 mg |
| ou | 100 mg |
| ou | 140 mg |
| ou | 180 mg |
| ou | 250 mg |
Teneur en lactose anhydre : 132,8 mg/gél à 5 mg ; 182,2 mg/gél à 20 mg ; 175,7 mg/gél à 100 mg ; 246 mg/gél à 140 mg ; 316,3 mg/gél à 180 mg ; 154,3 mg/gél à 250 mg.
| Poudre : | p ml* |
| Témozolomide (DCI) | 2,5 mg |
Chaque flacon contient 100 mg de témozolomide.
Teneur en sodium : 2,4 mmol/flacon.
* de solution reconstituée
INDICATIONS |
- des patients adultes atteints d'un glioblastome multiforme nouvellement diagnostiqué en association avec la radiothérapie (RT) puis en traitement en monothérapie ;
- des enfants à partir de 3 ans, des adolescents et des patients adultes atteints d'un gliome malin, tel que glioblastome multiforme ou astrocytome anaplasique, présentant une récidive ou une progression après un traitement standard.
POSOLOGIE ET MODE D'ADMINISTRATION |
Un traitement antiémétique peut être administré (cf Mises en garde et Précautions d'emploi).
Posologie :
- Patients adultes atteints d'un glioblastome multiforme nouvellement diagnostiqué :
- Temodal est administré en association avec la radiothérapie focale (phase concomitante), suivi de témozolomide (TMZ) en monothérapie jusqu'à 6 cycles (phase de monothérapie).
-
- Phase concomitante :
- Le TMZ est administré à une dose de 75 mg/m2 quotidiennement pendant 42 jours, en association à la radiothérapie focale (60 Gy administrés en 30 fractions). Aucune réduction de dose n'est recommandée, mais le report ou l'interruption de l'administration de TMZ doit être décidé de manière hebdomadaire selon des critères de toxicité hématologique et non hématologique.
- L'administration de TMZ peut être prolongée au-delà de la période concomitante de 42 jours (jusqu'à 49 jours) si toutes les conditions suivantes sont rencontrées :
- Taux de neutrophiles (PNN) en valeur absolue >= 1,5 × 109/l.
- Taux de plaquettes >= 100 × 109/l.
- Toxicité non hématologique selon la classification « Common Toxicity Criteria » (CTC) <= grade 1 (excepté pour l'alopécie, les nausées et les vomissements).
- Taux de neutrophiles (PNN) en valeur absolue >= 1,5 × 109/l.
- Pendant le traitement, une numération formule sanguine complète doit être effectuée chaque semaine. L'administration de TMZ doit être interrompue temporairement ou arrêtée définitivement pendant la phase concomitante selon les critères de toxicité hématologique et non hématologique tels que décrits dans le tableau 1.
-
Tableau 1 : Interruption temporaire ou arrêt définitif du traitement par TMZ pendant la phase concomitante par radiothérapie et TMZ Toxicité Interruption temporaire* du TMZ Arrêt définitif du TMZ Taux de neutrophiles en valeur absolue >= 0,5 et < 1,5 × 109/l < 0,5 × 109/l Taux de plaquettes >= 10 et < 100 × 109/l < 10 × 109/l Toxicité non hématologique CTC (excepté pour l'alopécie, les nausées, les vomissements) grade 2 CTC grades 3 ou 4 CTC -
*
Le traitement concomitant avec le TMZ peut être repris lorsque toutes les conditions suivantes sont rencontrées : taux de neutrophiles en valeur absolue >= 1,5 × 109/l ; taux de plaquettes >= 100 × 109/l ; toxicité non hématologique CTC <= grade 1 (excepté pour l'alopécie, les nausées, les vomissements).
-
- Phase de monothérapie :
- Quatre semaines après avoir terminé la phase concomitante de traitement par TMZ + radiothérapie, le TMZ est administré jusqu'à 6 cycles de traitement en monothérapie. La dose pendant le cycle 1 (monothérapie) est de 150 mg/m2 une fois par jour pendant 5 jours, suivis de 23 jours sans traitement. Au début du cycle 2, la dose est augmentée à 200 mg/m2 si la toxicité non hématologique CTC pour le cycle 1 est de grade <= 2 (excepté pour l'alopécie, les nausées et les vomissements), le taux de neutrophiles (PNN) en valeur absolue est >= 1,5 × 109/l, et le taux de plaquettes est >= 100 × 109/l. Si la dose n'est pas augmentée au cycle 2, l'augmentation ne doit pas être effectuée aux cycles suivants. Une fois augmentée, la dose demeure à 200 mg/m2 par jour pour les 5 premiers jours de chaque cycle suivant, à moins qu'une toxicité apparaisse. Les diminutions de dose et les arrêts pendant la phase de monothérapie doivent être effectuées selon les tableaux 2 et 3.
- Pendant le traitement, une numération formule sanguine complète doit être effectuée au jour 22 (21 jours après la première dose de TMZ). La dose doit être réduite ou l'administration interrompue selon le tableau 3.
-
Tableau 2 : Différents niveaux de dose de TMZ pour le traitement en monothérapie Niveau de dose Dose de TMZ (mg/m2/j) Remarques - 1 100 Diminution pour toxicité antérieure 0 150 Dose pendant le cycle 1 1 200 Dose pendant les cycles 2 à 6 en l'absence de toxicité -
Tableau 3 : Diminution de dose de TMZ ou arrêt pendant le traitement en monothérapie Toxicité Diminution de TMZ d'un niveau de dose* Arrêt du TMZ Taux de neutrophiles en valeur absolue < 1,0 × 109/l voir note** Taux de plaquettes < 50 × 109/l voir note** Toxicité non hématologique CTC (excepté pour l'alopécie, les nausées, les vomissements) grade 3 CTC grade 4** CTC -
*
Les niveaux de doses de TMZ sont listés dans le tableau 2.
-
**
Le TMZ doit être arrêté si :
- le niveau de posologie - 1 (100 mg/m2) provoque toujours une toxicité inacceptable,
- la même toxicité non hématologique grade 3 (excepté pour l'alopécie, les nausées, les vomissements) se reproduit après réduction de posologie.
- le niveau de posologie - 1 (100 mg/m2) provoque toujours une toxicité inacceptable,
- Patients adultes et enfants âgés de 3 ans ou plus atteints de gliome malin en progression ou récidive :
- Un cycle de traitement comprend 28 jours. Chez les patients n'ayant pas reçu de chimiothérapie au préalable, le TMZ est administré à la dose de 200 mg/m2 une fois par jour pendant les 5 premiers jours du cycle, puis le traitement devra être interrompu pendant les 23 jours suivants (total de 28 jours). Chez les patients ayant reçu une chimiothérapie préalable, la dose initiale est de 150 mg/m2 une fois par jour, puis est augmentée lors du second cycle à 200 mg/m2 une fois par jour pendant 5 jours, s'il n'y a pas de toxicité hématologique (cf Mises en garde et Précautions d'emploi).
- Populations spéciales :
-
- Enfants :
- Chez les enfants âgés de 3 ans ou plus, le TMZ est uniquement utilisé dans le traitement du gliome malin en progression ou récidive. Il n'y a pas d'expérience clinique de l'utilisation de TMZ chez l'enfant de moins de 3 ans. L'expérience chez les enfants plus âgés est très limitée (cf Mises en garde et Précautions d'emploi, Pharmacodynamie).
-
- Patients atteints d'insuffisance hépatique ou rénale :
- Les paramètres pharmacocinétiques du TMZ étaient comparables chez les patients ayant une fonction hépatique normale et chez ceux atteints d'une insuffisance hépatique faible ou modérée. Aucune donnée n'est disponible concernant l'administration de TMZ chez les patients atteints d'insuffisance hépatique sévère (stade C de la classification de Child) ou d'insuffisance rénale. Sur la base des propriétés pharmacocinétiques du TMZ, il est peu probable qu'une réduction de dose soit nécessaire chez les patients atteints d'insuffisance hépatique sévère ou de n'importe quel degré d'insuffisance rénale. Cependant, des précautions doivent être prises lorsque le TMZ est administré chez ces patients.
-
- Patients âgés :
- Sur la base d'une analyse pharmacocinétique de population chez des patients âgés de 19 à 78 ans, la clairance du TMZ n'est pas affectée par l'âge. Cependant, les patients âgés (> 70 ans) semblent avoir un risque augmenté de neutropénie et thrombocytopénie (cf Mises en garde et Précautions d'emploi).
Mode d'administration :
- Gélules :
- Temodal gélules doit être administré à jeun.
- Les gélules doivent être avalées entières avec un verre d'eau et ne doivent pas être ouvertes ni mâchées.
- Si des vomissements surviennent après l'administration de la dose, ne pas administrer une deuxième dose le même jour.
- Poudre pour solution pour perfusion :
- Temodal 2,5 mg/ml poudre pour solution pour perfusion doit être administré uniquement par voie intraveineuse. Il ne doit pas être administré par d'autres voies d'administration, telles que les voies intrathécale, intramusculaire, ou sous-cutanée.
- La dose appropriée de TMZ doit être perfusée par voie intraveineuse à l'aide d'une pompe pendant 90 minutes.
- De même que pour d'autres agents chimiothérapeutiques similaires, il est recommandé de l'utiliser avec prudence afin d'éviter toute extravasation. Des effets indésirables localisés au site d'injection, généralement modérés et disparaissant rapidement, ont été observés chez des patients recevant Temodal 2,5 mg/ml poudre pour solution pour perfusion. Des études précliniques n'ont montré aucune lésion permanente des tissus (cf Effets indésirables, Sécurité préclinique).
- Temodal est également disponible sous forme de gélules (voie orale). Temodal 2,5 mg/ml poudre pour solution pour perfusion, administré par perfusion intraveineuse de 90 minutes, est bioéquivalent à la forme gélule (cf Pharmacocinétique).
CONTRE-INDICATIONS |
- Hypersensibilité à la substance active ou à l'un des excipients.
- Hypersensibilité à la dacarbazine (DTIC).
- Myélosuppression sévère (cf Mises en garde et Précautions d'emploi).
MISES EN GARDE et PRÉCAUTIONS D'EMPLOI |
- Pneumonie à Pneumocystis carinii (PPC) :
- Dans un essai pilote les patients ayant reçu du TMZ de manière concomitante avec la RT sur un schéma prolongé de 42 jours ont montré un risque particulier de développer des pneumonies à Pneumocystis carinii (PPC). Ainsi, une prophylaxie pour la pneumonie à Pneumocystis carinii (PPC) est-elle requise pour tous les patients recevant du TMZ de manière concomitante à la RT pour les 42 jours de traitement (avec un maximum de 49 jours) quel que soit le taux de lymphocytes. Si une lymphopénie se produit, ils doivent continuer la prophylaxie jusqu'à retrouver une lymphopénie de grade <= 1.
- Il peut y avoir une fréquence plus importante de PPC quand le TMZ est administré selon un schéma de traitement plus long. Néanmoins, tous les patients recevant du TMZ, particulièrement les patients recevant des stéroïdes, doivent être surveillés attentivement concernant le développement de PPC quel que soit le schéma de traitement.
- Tumeurs malignes :
- Des cas de syndromes myélodysplasiques et de tumeurs malignes secondaires, incluant la leucémie myéloïde, ont également été observés, très rarement (cf Effets indésirables).
- Traitement antiémétique :
- Les nausées et les vomissements sont très fréquemment associés au TMZ.
- Un traitement antiémétique peut être administré avant ou après administration de TMZ.
-
- Patients adultes atteints d'un glioblastome multiforme nouvellement diagnostiqué :
- Une prophylaxie antiémétique est recommandée avant la dose initiale en phase concomitante. Une telle prophylaxie est fortement recommandée pendant la phase de monothérapie.
-
- Patients adultes atteints d'un gliome malin en progression ou récidive :
- Les patients qui ont eu des vomissements sévères (grades 3 ou 4) au cours des cycles de traitement antérieurs peuvent nécessiter un traitement antiémétique.
- Paramètres biologiques :
- Avant administration, les paramètres biologiques doivent être les suivants : PNN >= 1,5 × 109/l et taux de plaquettes >= 100 × 109/l. Une numération formule sanguine complète doit être effectuée au jour 22 (21 jours après la première dose) ou dans un délai de 48 heures suivant ce jour, et chaque semaine jusqu'à un taux PNN >= 1,5 × 109/l et un taux de plaquettes >= 100 × 109/l. Si le taux de PNN tombe à une valeur < 1,0 × 109/l ou le taux de plaquettes est < 50 × 109/l pendant n'importe quel cycle, la dose doit être diminuée d'un niveau au prochain cycle (cf Posologie et Mode d'administration). Les niveaux de doses incluent 100 mg/m2,150 mg/m2, et 200 mg/m2. La plus basse dose recommandée est 100 mg/m2.
- Utilisation en pédiatrie :
- Il n'existe aucune expérience clinique de l'utilisation de TMZ chez les enfants de moins de 3 ans. L'expérience chez les enfants plus âgés et les adolescents est très limitée (cf Posologie et Mode d'administration, Pharmacodynamie).
- Patients âgés (> 70 ans) :
- Les patients âgés semblent avoir un risque augmenté de neutropénie et de thrombocytopénie comparativement aux patients plus jeunes. Par conséquent, une attention particulière est nécessaire lorsque le TMZ est administré chez les patients âgés.
- Hommes traités :
- Il est conseillé aux hommes traités par le TMZ de ne pas procréer jusqu'à 6 mois après la dernière dose prise et de se renseigner sur la cryoconservation du sperme avant d'initier le traitement (cf Grossesse et Allaitement).
- Lactose (gélules) :
- Temodal gélules contient du lactose. Son utilisation est déconseillée chez les patients présentant une intolérance au galactose, un déficit en lactase de Lapp ou un syndrome de malabsorption du glucose et du galactose (maladies héréditaires rares).
- Sodium (poudre pour solution pour perfusion) :
- Temodal poudre pour solution pour perfusion contient 2,4 mmol de sodium par flacon. A prendre en compte chez les patients suivant un régime hyposodé strict.
INTERACTIONS |
- Les études d'interaction n'ont été réalisées que chez l'adulte.
- Dans une autre étude de phase I, l'administration simultanée de TMZ et de ranitidine ne modifie pas l'absorption du témozolomide ou l'exposition à son métabolite actif le monométhyl triazéno-imidazole carboxamide (MTIC).
- Selon une analyse pharmacocinétique de population lors des essais de phase II, l'administration concomitante de dexaméthasone, de prochlorpérazine, de phénytoïne, de carbamazépine, d'ondansétron, d'antagonistes des récepteurs H2 ou de phénobarbital ne modifie pas la clairance du TMZ. L'administration concomitante d'acide valproïque a été associée à une diminution faible mais statistiquement significative de la clairance du TMZ.
- Aucune étude n'a été réalisée pour déterminer l'effet du TMZ sur le métabolisme ou l'élimination d'autres médicaments. Cependant, comme le TMZ ne subit pas de métabolisme hépatique et présente une faible liaison aux protéines plasmatiques, il ne devrait pas affecter les paramètres pharmacocinétiques d'autres médicaments (cf Pharmacocinétique).
- L'utilisation de TMZ en association avec d'autres agents myélosuppresseurs est susceptible d'accroître le risque de myélosuppression.
- Temodal gélules : L'administration de TMZ lors des repas se traduit par une diminution de 33 % de la Cmax et par une diminution de 9 % de l'aire sous la courbe (ASC).
Comme on ne peut pas exclure que ce changement de la Cmax ait une signification clinique, Temodal doit être administré en dehors des repas.
GROSSESSE et ALLAITEMENT |
Il n'existe aucune donnée chez la femme enceinte. Lors des études précliniques conduites chez le rat et le lapin recevant la dose de 150 mg/m2 de TMZ, des effets tératogènes et/ou toxiques pour le foetus ont été démontrés (cf Sécurité préclinique).
Temodal ne doit pas être administré chez la femme enceinte. Si l'administration est envisagée pendant la grossesse, la patiente doit être prévenue du risque potentiel pour le foetus. Il est conseillé aux femmes en âge de procréer d'utiliser une contraception efficace afin d'éviter toute grossesse lors de la prise du TMZ.
Allaitement :
On ne sait pas si le TMZ est excrété dans le lait maternel ; par conséquent, l'allaitement doit être interrompu pendant le traitement par TMZ.
Fertilité masculine et contraception :Le TMZ peut avoir des effets génotoxiques. Par conséquent, il est conseillé aux hommes traités par ce dernier de ne pas procréer jusqu'à 6 mois après avoir reçu la dernière dose, et de se renseigner sur la cryoconservation du sperme avant d'initier le traitement, compte tenu de la possibilité d'infertilité irréversible due à la thérapie avec le TMZ.
CONDUITE et UTILISATION DE MACHINES |
EFFETS INDÉSIRABLES |
- Expérience issue d'essai clinique réalisé avec les gélules :
- Chez les patients traités avec le TMZ, que celui-ci soit utilisé en association avec la RT ou en monothérapie suivi d'une RT pour un glioblastome multiforme nouvellement diagnostiqué, ou qu'il soit administré en monothérapie chez les patients atteints d'un gliome en progression ou récidive, les effets indésirables très fréquents rapportés étaient similaires : nausées, vomissements, constipation, anorexie, mal de tête et fatigue. Des convulsions ont été rapportées très fréquemment chez les patients ayant un glioblastome multiforme nouvellement diagnostiqué en monothérapie, et un rash a été rapporté très fréquemment chez les patients ayant un glioblastome multiforme nouvellement diagnostiqué recevant le TMZ et la RT de manière concomitante, et également en monothérapie, et fréquemment chez les patients présentant un gliome en récidive. La plupart des effets indésirables hématologiques ont été rapportées fréquemment ou très fréquemment dans les deux indications (tableaux 4 et 5) ; la fréquence des anomalies des paramètres biologiques de grade 3-4 est mentionnée après chaque tableau.
- Dans les tableaux, les effets indésirables sont listés selon la classification des systèmes d'organe et par fréquence. Les groupes de fréquence sont définis selon la convention suivante : très fréquent (>= 1/10) ; fréquent (>= 1/100, < 1/10) ; peu fréquent (>= 1/1000, < 1/100). Au sein de chaque groupe de fréquence, les effets indésirables doivent être présentés suivant un ordre décroissant de gravité.
-
- Glioblastome multiforme nouvellement diagnostiqué :
- Le tableau 4 rapporte les effets indésirables liés au traitement observés chez les patients atteints d'un glioblastome multiforme nouvellement diagnostiqué pendant les phases concomitante et de monothérapie du traitement.
-
Tableau 4 : Effets liés au traitement observés pendant les phases concomitante et de monothérapie du traitement chez les patients atteints d'un glioblastome multiforme nouvellement diagnostiqué Classification des systèmes d'organe TMZ + RT concomitante
n = 288*TMZ
en monothérapie
n = 224Infections et infestations : - Fréquent
Infection, Herpes simplex, infection des plaies , pharyngite, candidose orale Infection, candidose orale - Peu fréquent
Herpes simplex, zona, symptômes pseudogrippaux Affections hématologiques et du système lymphatique : - Fréquent
Neutropénie, thrombocytopénie, lymphopénie, leucopénie Neutropénie fébrile, thrombocytopénie, anémie, leucopénie - Peu fréquent
Neutropénie fébrile, anémie Lymphopénie, pétéchie Affections endocriniennes : - Peu fréquent
Syndrome cushingoïde Syndrome cushingoïde Troubles du métabolisme et de la nutrition : - Très fréquent
Anorexie Anorexie - Fréquent
Hyperglycémie, perte de poids Perte de poids - Peu fréquent
Hypokaliémie, augmentation des phosphatases alcalines, prise de poids Hyperglycémie, prise de poids Affections psychiatriques : - Fréquent
Anxiété, instabilité émotionnelle, insomnie Anxiété, dépression, instabilité émotionnelle, insomnie - Peu fréquent
Agitation, apathie, trouble du comportement, dépression, hallucination Hallucination, amnésie Affections du système nerveux : - Très fréquent
Céphalée Convulsions, céphalée - Fréquent
Convulsions, baisse de conscience, somnolence, aphasie, troubles de l'équilibre, étourdissements, confusion, troubles de la mémoire, concentration altérée, neuropathie, paresthésie, trouble de la parole, tremblements Hémiparésie, aphasie, troubles de l'équilibre, somnolence, confusion, étourdissements, troubles de la mémoire, concentration altérée, dysphasie, troubles neurologiques (NOS), neuropathie, neuropathie périphérique, paresthésie, trouble de la parole, tremblements - Peu fréquent
État de mal épileptique, trouble extrapyramidal, hémiparésie, ataxie, altération de la cognition, dysphasie, démarche anormale, hyperesthésie, hypoesthésie, troubles neurologiques (NOS), neuropathie périphérique Hémiplégie, ataxie, coordination anormale, démarche anormale, hyperesthésie, trouble sensoriel Affections oculaires : - Fréquent
Vision floue Trouble du champ visuel, vision floue, diplopie - Peu fréquent
Hémianopsie, acuité visuelle réduite, trouble de la vision, défaut du champ visuel, douleur oculaire Acuité visuelle réduite, douleur oculaire, sécheresse oculaire Affections de l'oreille et du labyrinthe : - Fréquent
Baisse de l'audition Baisse de l'audition, acouphène - Peu fréquent
Otite moyenne, acouphène, hyperacousie, douleur à l'oreille Surdité, vertige, douleur à l'oreille Affections cardiaques : - Fréquent
Palpitation Affections vasculaires : - Fréquent
Hémorragie, oedème, oedème des jambes Hémorragie, thrombose veineuse profonde, oedème des jambes - Peu fréquent
Hémorragie cérébrale, hypertension Embolie pulmonaire, oedème, oedème périphérique Affections respiratoires, thoraciques et médiastinales : - Fréquent
Dyspnée, toux Dyspnée, toux - Peu fréquent
Pneumonie, infection des voies aériennes hautes, congestion nasale Pneumonie, sinusite, infection des voies aériennes hautes, bronchite Affections gastro-intestinales : - Très fréquent
Constipation, nausées, vomissements Constipation, nausées, vomissements - Fréquent
Stomatite, diarrhée, douleur abdominale, dyspepsie, dysphagie Stomatite, diarrhée, dyspepsie, dysphagie, bouche sèche - Peu fréquent
Distension abdominale, incontinence fécale, troubles gastro-intestinaux (NOS), gastro-entérite, hémorroïdes Affections de la peau et du tissu sous-cutané : - Très fréquent
Alopécie, rash Alopécie, rash - Fréquent
Dermatite, sécheresse cutanée, érythème, prurit Sécheresse cutanée, prurit - Peu fréquent
Exfoliation cutanée, réaction de photosensitivité, pigmentation anormale Érythème, pigmentation anormale, transpiration accrue Affections musculosquelettiques et systémiques : - Fréquent
Faiblesse musculaire, arthralgie Faiblesse musculaire, arthralgie, douleur musculosquelettique, myalgie - Peu fréquent
Myopathie, douleur dorsale, douleur musculosquelettique, myalgie Myopathie, douleur dorsale Affections du rein et des voies urinaires : - Fréquent
Miction fréquente, incontinence urinaire Incontinence urinaire - Peu fréquent
Dysurie Affections des organes de reproduction et du sein : - Peu fréquent
Impuissance Hémorragie vaginale, ménorragie, aménorrhée, vaginite, douleur mammaire Troubles généraux et anomalies au site d'administration : - Très fréquent
Fatigue Fatigue - Fréquent
Réaction allergique, fièvre, lésions radiques, oedème de la face, douleur, perversion du goût Réaction allergique, fièvre, lésions radiques, douleur, perversion du goût - Peu fréquent
Asthénie, bouffées vasomotrices, bouffées de chaleur, aggravation de l'état, raideur, décoloration de la langue, parosmie, soif Asthénie, oedème de la face, douleur, aggravation de l'état, raideur, trouble dentaire, perversion du goût Investigations : - Fréquent
Augmentation des ALAT Augmentation des ALAT - Peu fréquent
Augmentation des enzymes hépatiques, augmentation des gamma-GT, augmentation des ASAT -
*
Un patient randomisé dans le bras radiothérapie seule a reçu TMZ + RT.
- Résultats de laboratoire :
- Une myélosuppression (neutropénie et thrombocytopénie), qui est connue comme étant la toxicité dose-limitante de la plupart des agents cytotoxiques, y compris le TMZ, a été observée. Parmi les anomalies de laboratoire associées à des événements indésirables apparues au cours de la phase concomitante et de monothérapie, les anomalies de neutrophiles de grade 3 ou 4 incluant les événements neutropéniques étaient observées chez 8 % des patients. Les anomalies de grade 3 ou 4 des thrombocytes, incluant les événements de thrombocytopénie ont été observées chez 14 % des patients qui recevaient du TMZ.
-
- Gliome malin en progression ou récidive :
- Lors des essais cliniques, les effets indésirables liés au traitement le plus fréquemment rapportés ont été des troubles gastro-intestinaux, plus particulièrement nausées (43 %) et vomissements (36 %). Ces effets ont été habituellement de grade 1 ou 2 (0 à 5 épisodes de vomissements par 24 heures) et ont disparu spontanément ou ont été rapidement contrôlées par un traitement antiémétique standard. L'incidence des nausées et vomissements sévères a été de 4 %.
- Le tableau 5 comprend les effets indésirables rapportées lors des essais cliniques dans le cadre de gliome malin en progression ou récidive et suite à la mise sur le marché de Temodal.
-
Tableau 5 : Effets indésirables chez les patients atteints d'un gliome malin en progression ou récidive Infections et infestations : - Rare
Infections opportunistes, incluant pneumonie à Pneumocystis carinii (PPC) Affections hématologiques et du système lymphatique : - Très fréquent
Neutropénie ou lymphopénie (grade 3-4), thrombocytopénie (grade 3-4) - Peu fréquent
Pancytopénie, anémie (grade 3-4), leucopénie Troubles du métabolisme et de la nutrition : - Très fréquent
Anorexie - Fréquent
Perte de poids Affections du système nerveux : - Très fréquent
Céphalée - Fréquent
Somnolence, étourdissements, paresthésie Affections respiratoires, thoraciques et médiastinales : - Fréquent
Dyspnée Affections gastro-intestinales : - Très fréquent
Vomissements, nausées, constipation - Fréquent
Diarrhée, douleur abdominale, dyspepsie Affections de la peau et du tissu sous-cutané : - Fréquent
Rash, prurit, alopécie - Très rare
Érythème multiforme, érythrodermie, urticaire, exanthème Troubles généraux et anomalies au site d'administration : - Très fréquent
Fatigue - Fréquent
Fièvre, asthénie, raideur, malaise, douleur, perversion du goût - Très rare
Réactions allergiques, incluant anaphylaxie, angioedème - Résultats de laboratoire :
- Une thrombocytopénie et une neutropénie de grade 3 ou 4 sont survenues respectivement chez 19 % et 17 % des patients traités pour gliome malin. Cela a entraîné une hospitalisation et/ou un arrêt du TMZ respectivement chez 8 % et 4 % des patients. La myélosuppression était prévisible (habituellement lors des premiers cycles de traitement, avec un nadir entre le jour 21 et le jour 28), et rapidement réversible, généralement en 1 à 2 semaines. Il n'a pas été observé de myélosuppression cumulative. La présence de thrombocytopénie peut augmenter le risque de saignements, et la présence de neutropénie ou de leucopénie peut augmenter le risque d'infection.
-
- Genre :
- Dans une analyse pharmacocinétique de population d'un essai clinique, il y a eu 101 femmes et 169 hommes pour qui les taux de nadir des neutrophiles étaient disponibles, et 110 femmes et 174 hommes pour qui les taux de nadir des plaquettes étaient disponibles. Il y a eu des taux supérieurs de neutropénie de grade 4 (PNN < 0,5 x 109/l), 12 % versus 5 %, et de thrombocytopénie (< 20 x 109/l), 9 % versus 3 %, chez les femmes versus chez les hommes durant le premier cycle du traitement. Dans une série de 400 sujets ayant un gliome en récidive, une neutropénie de grade 4 est survenue chez 8 % des femmes versus 4 % des hommes et une thrombocytopénie de grade 4 chez 8 % des femmes versus 3 % des hommes durant le premier cycle du traitement. Dans une étude de 288 sujets avec un glioblastome multiforme nouvellement diagnostiqué, une neutropénie de grade 4 survenait chez 3 % des femmes versus 0 % des hommes et une thrombopénie de grade 4 chez 1 % des femmes versus 0 % des hommes durant le premier cycle du traitement.
- Expérience issue d'essai clinique avec la forme IV :
- Temodal 2,5 mg/ml poudre pour solution pour perfusion délivre une dose de TMZ équivalente à celle des gélules de Temodal et entraîne également une exposition similaire au TMZ et à son métabolite actif MTIC (cf Pharmacocinétique). Les effets indésirables rapportés au cours des deux études avec la formulation IV (n = 35), mais non rapportées dans les études utilisant Temodal gélules, étaient les réactions liées au site de perfusion : douleur, irritation, prurit, sensation de chaleur, gonflement, et érythème, ainsi qu'hématome.
- Depuis la commercialisation :
- Les agents antinéoplasiques, et particulièrement les agents alkylants, ont été associés à un risque potentiel de syndrome myélodysplasique (SMD) et des tumeurs malignes secondaires, incluant la leucémie. De très rares cas de SMD et de tumeurs malignes secondaires, incluant la leucémie myéloïde ont été rapportés chez des patients recevant des traitements comprenant du TMZ. Une pancytopénie prolongée qui peut engendrer une anémie aplastique a été très rarement rapportée.
- Des cas de nécrolyse épidermique toxique et de syndrome de Stevens-Johnson ont été très rarement rapportés.
- Des cas de pneumopathies ou de pneumopathies interstitielles ont été très rarement rapportés.
SURDOSAGE |
PHARMACODYNAMIE |
Classe pharmacothérapeutique : Agents antinéoplasiques, autres agents alkylants (code ATC : L01AX03).
Le témozolomide est un dérivé triazène qui subit une conversion chimique rapide à pH physiologique en monométhyl triazéno-imidazole carboxamide actif (MTIC). La cytotoxicité du MTIC est vraisemblablement due principalement à une alkylation de la guanine en position O6 et à une alkylation supplémentaire en position N7. Les lésions cytotoxiques qui sont développées par la suite sont supposées entraîner une réparation aberrante de l'ADN méthylé.
- Glioblastome multiforme nouvellement diagnostiqué :
- Un total de 573 patients ont été randomisés pour recevoir soit TMZ + RT (n = 287) soit RT seule (n = 286). Les patients dans le bras TMZ + RT ont reçu le TMZ concomitant (75 mg/m2) une fois par jour, en commençant le premier jour de la RT jusqu'au dernier jour de la RT, pendant 42 jours (avec un maximum de 49 jours). Ceci a été suivi de TMZ en monothérapie (150-200 mg/m2) les jours 1 à 5 de chaque cycle de 28 jours, jusqu'à 6 cycles, commençant 4 semaines après la fin de la RT. Les patients dans le bras contrôle ont reçu seulement de la RT. La prophylaxie de la pneumonie à Pneumocystis carinii (PPC) a été exigée pendant le traitement par RT et TMZ associés.
- Le TMZ a été administré comme traitement d'entretien dans la phase de suivi chez 161 des 282 patients (57 %) dans le bras radiothérapie seule, et 62 des 277 patients (22 %) dans le bras TMZ + RT.
- Le hazard ratio (HR) pour la survie globale était 1,59 (95 % IC pour HR = 1,33-1,91) avec un log-rank p < 0,0001 en faveur du bras TMZ. La probabilité estimée de survie à 2 ans ou plus (26 % vs 10 %) est plus importante pour le bras RT + TMZ. L'addition de TMZ de manière concomitante à la RT, suivie de TMZ en monothérapie dans le traitement des patients avec un glioblastome multiforme nouvellement diagnostiqué, a démontré une amélioration de la survie globale (SG) statistiquement significative comparée à la RT seule (cf figure ci-dessous).
-
Courbe de Kaplan-Meier pour la survie globale (population ITT [Intent-to-Treat]) : 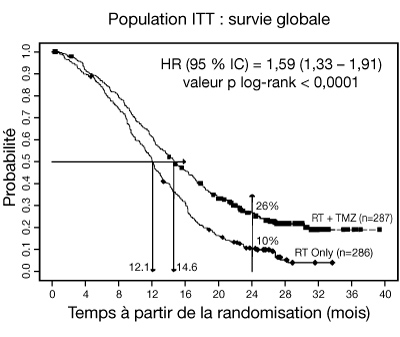
- Les résultats de l'étude n'étaient pas cohérents dans le sous-groupe de patients avec un faible « performance status » (OMS, PS = 2, n = 70), où la survie globale et le temps de progression étaient similaires dans les deux bras. Cependant, aucun risque inacceptable ne semble avoir été décelé dans ce groupe de patients.
- Gliome malin en progression ou récidive :
- Les données d'efficacité clinique chez les patients atteints de glioblastome multiforme (indice de performance Karnofsky [IPK] >= 70), en progression ou récidivant après une chirurgie et une RT, proviennent de deux essais cliniques avec TMZ par voie orale. L'un était un essai non comparatif chez 138 patients (29 % avaient reçu une chimiothérapie préalable), et l'autre était un essai randomisé contrôlé contre référence active comparant TMZ versus procarbazine, chez un total de 225 patients (67 % avaient reçu une chimiothérapie préalable à base de nitroso-urée). Dans les deux essais, le critère d'évaluation principal était la survie sans progression (SSP) définie par imagerie de résonance médicale (IRM) ou une aggravation neurologique. Dans l'essai non comparatif, la SSP à 6 mois était de 19 %, la survie médiane sans progression était de 2,1 mois, et la survie médiane globale de 5,4 mois. Le taux de réponse objective (TRO), défini par des IRM, était de 8 %.
- Dans l'essai randomisé contrôlé contre référence active, la SSP à 6 mois était significativement plus importante pour le TMZ que pour la procarbazine (21 % versus 8 %, respectivement - Chi2 : p = 0,008) avec une SSP moyenne de 2,89 et 1,88 mois, respectivement (log rank p = 0,0063). La survie médiane était de 7,34 et 5,66 mois respectivement pour le TMZ et la procarbazine (log rank p = 0,33). A 6 mois, le pourcentage des patients survivants était significativement plus élevé dans le bras TMZ (60 %) comparé au bras procarbazine (44 % ; Chi2 : p = 0,019). Chez les patients préalablement traités par chimiothérapie, un bénéfice a été noté pour ceux ayant un IPK >= 80.
- Les données sur la durée jusqu'à aggravation de l'état neurologique comme celles sur la durée jusqu'à aggravation de l'indice de performance (diminution jusqu'à un IPK < 70 ou diminution d'au moins 30 points) étaient en faveur du TMZ par rapport à la procarbazine. Les temps médians jusqu'à progression pour ces critères d'évaluation sont plus longs pour le TMZ que pour la procarbazine, entre 0,7 et 2,1 mois (log rank p = < 0,01 à 0,03).
- Astrocytome anaplasique en récidive :
- Lors d'un essai de phase II prospectif, multicentrique évaluant la sécurité et l'efficacité du TMZ oral dans le traitement des patients atteints d'astrocytome anaplasique en première rechute, la survie sans progression (SSP) à 6 mois était de 46 %. La médiane de la SSP était de 5,4 mois. La médiane de la survie globale était de 14,6 mois. Le taux de réponse, basé sur une revue centralisée, était de 35 % (13 RC et 43 RP) sur la population en intention de traiter (ITT) [n = 162]. Chez 43 patients, la stabilité de la maladie a été rapportée. La survie sans événement à 6 mois pour la population en intention de traiter était de 44 % avec une médiane de survie sans événement de 4,6 mois, ce qui était identique aux résultats de survie sans progression. Pour la population histologiquement éligible, les résultats d'efficacité étaient identiques. L'obtention d'une réponse radiologique objective ou le maintien d'une stabilisation sans progression était fortement associé(e) à une qualité de vie maintenue ou améliorée.
- Enfants :
- Le TMZ oral a été étudié chez les enfants (3-18 ans) atteints d'un gliome du tronc cérébral en récidive ou d'un astrocytome de haut grade en récidive, administré quotidiennement pendant 5 jours tous les 28 jours. La tolérance au TMZ était similaire à celle de l'adulte.
PHARMACOCINÉTIQUE |
Le TMZ est spontanément hydrolysé au pH physiologique principalement en ses métabolites actifs, 3-méthyl-(triazen-1-yl)imidazole-4-carboxamide (MTIC). Le MTIC est spontanément hydrolysé en 5-amino-imidazole-4-carboxamide (AIC), un intermédiaire connu dans la biosynthèse de la purine et de l'acide nucléique, et en méthylhydrazine, dont on pense qu'il s'agit du métabolite actif alkylant. Il semble que la cytotoxicité du MTIC soit principalement due à l'alkylation de l'ADN, essentiellement aux positions O6 et N7 de la guanine. Concernant l'ASC du TMZ, l'exposition aux MTIC et AIC est ~ 2,4 % et 23 %, respectivement. In vivo, le t½ du MTIC était similaire à celui du TMZ, 1,8 heure.
Dans une étude de bioéquivalence en ouvert, en crossover et en situation bilatérale portant sur la pharmacocinétique du TMZ par voie orale et par voie intraveineuse chez des patients présentant des tumeurs malignes primaires du SNC, Temodal 2,5 mg/ml poudre pour solution pour perfusion administré sur une durée de 90 minutes a été bioéquivalent en termes de Cmax et d'AUC pour le TMZ et le MTIC à Temodal en gélules administré à la dose de 150 mg/m2. Les valeurs moyennes de la Cmax pour le TMZ et le MTIC étaient respectivement de 7,4 µg/ml et 320 ng/ml 90 minutes après la perfusion intraveineuse. Les valeurs moyennes de l'ASC(0=>infini ) pour le TMZ et le MTIC étaient respectivement de 25 µg.h/ml et de 1004.h/ml.
- Absorption :
- Après administration orale chez l'adulte, le TMZ est rapidement absorbé, avec des pics de concentration observés parfois dès 20 minutes après administration (temps moyen compris entre 0,5 et 1,5 heure). Après administration orale de TMZ marqué au 14C, l'excrétion fécale moyenne de 14C dans les 7 jours suivant l'administration était de 0,8 %, signe d'une absorption complète.
- Distribution :
- Le TMZ est faiblement lié aux protéines plasmatiques (10 à 20 %) et, par conséquent, est peu susceptible d'interagir avec des produits très fortement liés aux protéines.
- Les études cliniques utilisant la technique de TEP (tomographie par émission de positrons) et les données précliniques suggèrent que le TMZ traverse rapidement la barrière hématoencéphalique et se retrouve dans le liquide céphalorachidien (LCR). La pénétration dans le LCR a été confirmée chez un patient. Sur la base de l'ASC du TMZ, l'exposition du LCR était approximativement 30 % de celle du plasma, ce qui est cohérent avec les données chez l'animal.
- Élimination :
- La demi-vie plasmatique (t½) est approximativement de 1,8 heures. La voie principale d'élimination du 14C est la voie rénale. Après administration orale, environ 5 à 10 % de la dose sont retrouvés sous forme inchangée dans les urines dans les 24 heures, et le reste est excrété sous forme d'acide témozolomide, de 5-amino-imidazole-4-carboxamide (AIC) ou de métabolites polaires non identifiés.
- L'augmentation des concentrations plasmatiques est dose-dépendante. La clairance plasmatique, le volume de distribution et la demi-vie sont indépendants de la dose.
- Populations spéciales :
- L'analyse des paramètres pharmacocinétiques de population du TMZ a montré que la clairance du TMZ est indépendante de l'âge, de la fonction rénale ou de la consommation de tabac. Dans une autre étude pharmacocinétique, les profils pharmacocinétiques des patients atteints de dysfonctionnement hépatique faible à modéré étaient identiques à ceux observés chez les patients dont la fonction hépatique était normale.
- Les enfants présentent une ASC plus élevée que les adultes ; cependant, la dose maximale tolérée (DMT) est de 1000 mg/m2 par cycle de traitement à la fois chez l'enfant et chez l'adulte.
SÉCURITE PRÉCLINIQUE |
Des études de toxicité à cycle unique (5 jours de traitement, 23 jours sans traitement), à 3 et 6 cycles ont été réalisées chez le rat et le chien. Les principales cibles de la toxicité ont été la moelle osseuse, le système lymphoréticulaire, les testicules, le tractus gastro-intestinal et, pour des doses plus fortes, létales chez 60 % à 100 % des rats et des chiens testés, une dégénérescence rétinienne est survenue. La plupart des phénomènes toxiques ont été réversibles, à l'exception des effets secondaires sur le système de reproduction mâle et de la dégénérescence rétinienne. Cependant, comme les doses impliquées dans cette dégénérescence appartiennent à l'intervalle de doses létales et qu'aucun effet semblable n'a été observé lors des études cliniques, ce résultat n'a pas de signification clinique.
Le TMZ est un agent alkylant embryotoxique, tératogène et génotoxique. Le TMZ est plus toxique chez le rat et le chien que chez l'homme, et la dose thérapeutique est proche de la dose létale minimale chez le rat et le chien. Les diminutions dose-dépendantes du nombre des leucocytes et des plaquettes apparaissent comme des indicateurs sensibles de la toxicité. Différents types de néoplasmes ont été observés lors de l'étude de toxicité après 6 cycles de traitement chez le rat, dont : carcinome mammaire, kérato-acanthome cutané et adénome baso-cellulaire, alors qu'aucune tumeur, ni aucun changement prénéoplasique n'ont été observés au cours des études chez le chien. Le rat semble être particulièrement sensible aux effets oncogènes du TMZ, avec l'apparition des premières tumeurs dans les 3 mois suivant le début du traitement. La période de latence est très courte, même pour un agent alkylant.
Les résultats des tests d'Ames/Salmonella et d'aberration chromosomique sur lymphocyte humain démontrent l'existence d'un potentiel mutagène.
La formulation par voie intraveineuse a provoqué des irritations locales au site d'injection à la fois chez le lapin et chez le rat. Cette irritation était transitoire et non associée à une lésion durable des tissus.
INCOMPATIBILITÉS |
En l'absence d'études de compatibilité, Temodal 2,5 mg/ml poudre pour solution pour perfusion ne doit pas être mélangé avec d'autres médicaments.
MODALITÉS DE CONSERVATION |
- Durée de conservation :
- 3 ans.
- Gélules en flacon :
- A conserver à une température ne dépassant pas 30 °C.
- A conserver dans le flacon d'origine à l'abri de l'humidité. Conserver le flacon soigneusement fermé.
- Gélules en sachets-dose :
- A conserver à une température ne dépassant pas 30 °C.
- Poudre pour solution pour perfusion :
- A conserver au réfrigérateur (2 °C à 8 °C).
- Après reconstitution : La stabilité chimique et physique de la solution en cours d'utilisation a été démontrée pendant 14 heures à 25 °C, durée de perfusion comprise.
- D'un point de vue microbiologique, ce produit doit être utilisé extemporanément. S'il n'est pas utilisé immédiatement, les durées et les conditions de conservation avant utilisation relèvent de la responsabilité de l'utilisateur et ne devraient pas excéder 24 heures entre 2 °C et 8 °C, à moins que la reconstitution soit effectuée dans des conditions d'aseptie contrôlées et validées.
MODALITÉS MANIPULATION/ÉLIMINATION |
- Temodal gélules :
- Les gélules ne doivent pas être ouvertes. Lorsqu'une gélule est détériorée, tout contact entre la poudre et la peau ou les muqueuses doit être évité. En cas de contact de Temodal avec la peau ou les muqueuses, laver immédiatement et abondamment à l'eau et au savon.
- Les patients devront être avertis de tenir les gélules hors de la portée et de la vue des enfants, de préférence dans un endroit fermé à clé. L'ingestion accidentelle peut être mortelle pour les enfants.
- Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
- Temodal poudre pour solution pour perfusion :
- Des précautions doivent être prises lors de la manipulation de Temodal 2,5 mg/ml poudre pour solution pour perfusion. Le port de gants est requis et des conditions d'aseptie sont nécessaires. En cas de contact avec Temodal 2,5 mg/ml avec la peau ou les muqueuses, laver immédiatement et abondamment à l'eau et au savon.
- Chaque flacon doit être reconstitué avec 41 ml d'eau stérile pour injection. La solution obtenue contient 2,5 mg/ml de TMZ. Les flacons doivent être tournés doucement et ne doivent pas être secoués. La solution doit être inspectée et tout flacon contenant des particules visibles ne doit pas être utilisé. Un volume jusqu'à 40 ml de la solution reconstituée devra être prélevé selon la dose totale prescrite et sera versé dans une poche vide pour perfusion en PVC de 250 ml. Aucune étude n'a été menée avec des poches en matériau autre que le PVC. Le tube de la pompe devra être raccordé à la poche, le tube devra être purgé puis capuchonné. Temodal 2,5 mg/ml doit être administré par perfusion intraveineuse uniquement, sur une durée de 90 minutes.
- En l'absence d'études de compatibilité, ce médicament ne doit pas être mélangé avec d'autres médicaments ou perfusé simultanément par la même ligne de perfusion.
- Ce médicament est à usage unique seulement. Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| Médicament soumis à prescription hospitalière. Prescription réservée aux spécialistes en oncologie ou en hématologie, ou aux médecins compétents en cancérologie. | |
| Médicament nécessitant une surveillance particulière pendant le traitement. | |
| AMM | EU/1/98/096/024 ; CIP 3400957595050 (bte de 5 sach-dose de 1 gél à 5 mg). |
| EU/1/98/096/013 ; CIP 3400957474591 (bte de 5 sach-dose de 1 gél à 20 mg). | |
| EU/1/98/096/015 ; CIP 3400957474713 (bte de 5 sach-dose de 1 gél à 100 mg). | |
| EU/1/98/096/017 ; CIP 3400957474942 (bte de 5 sach-dose de 1 gél à 140 mg). | |
| EU/1/98/096/019 ; CIP 3400957475192 (bte de 5 sach-dose de 1 gél à 180 mg). | |
| EU/1/98/096/021 ; CIP 3400957475314 (bte de 5 sach-dose de 1 gél à 250 mg). | |
| EU/1/98/096/023 ; CIP 3400957475543 (fl de pdre p sol p perf à 2,5 mg/ml). | |
| RCP révisés le 09.02.2010. | |
| Poudre pour solution pour perfusion : Non remboursable à la date du 21.06.10 (demande d'admission à l'étude). Collect. | |
| Prix ou tarif de responsabilité (HT) par UCD : | UCD 9203087 (gélule à 5 mg) : 4.00 euros. |
| UCD 9203064 (gélule à 20 mg) : 17.28 euros. | |
| UCD 9203058 (gélule à 100 mg) : 86.39 euros. | |
| UCD 9330265 (gélule à 140 mg) : 120.96 euros. | |
| UCD 9330271 (gélule à 180 mg) : 155.52 euros. | |
| UCD 9203070 (gélule à 250 mg) : 215.98 euros. | |
| Inscrit sur la liste de rétrocession avec prise en charge à 100 %. Collect. | |
Titulaire de l'AMM : Schering-Plough Europe.
Représentant local :
SCHERING-PLOUGH
34, av Léonard-de-Vinci. 92400 Courbevoie
Standard : Tél : 01 80 46 40 00
Info médic : Tél : 01 80 46 40 40
Pharmacovigilance : Tél : 01 80 46 46 46
