DÉCAPEPTYL® LP 11,25 mg
triptoréline
FORMES et PRÉSENTATIONS |
COMPOSITION |
| Poudre : | p dose injectée | |
| Triptoréline (DCI) pamoate exprimé en triptoréline | 11,25 mg* | |
Solvant : mannitol, eau ppi.
* Compte tenu des caractéristiques de la forme pharmaceutique, chaque flacon contient une quantité de pamoate de triptoréline correspondant à 15 mg de triptoréline.
INDICATIONS |
- Cancer de la prostate :
- Traitement du cancer de la prostate localement avancé ou métastatique.
- Un effet favorable du médicament est d'autant plus net et plus fréquent que le patient n'a pas reçu auparavant un autre traitement hormonal.
- Endométriose à localisation génitale et extragénitale (du stade I au stade IV) :
- La durée du traitement est limitée à 6 mois (cf Effets indésirables). Il n'est pas souhaitable d'entreprendre une seconde cure par la triptoréline ou par un autre analogue de la GnRH.
POSOLOGIE ET MODE D'ADMINISTRATION |
- Cancer de la prostate :
- Une injection intramusculaire de Décapeptyl LP 11,25 mg renouvelée tous les trois mois.
- Endométriose :
- Une injection intramusculaire de Décapeptyl LP 11,25 mg renouvelée tous les trois mois.
- Le traitement doit être débuté dans les 5 premiers jours du cycle.
- Durée du traitement : Elle dépend de la gravité initiale de l'endométriose et de l'évolution sous traitement de ses manifestations cliniques (fonctionnelles et anatomiques). En principe, elle est de 3 mois au moins et de 6 mois au maximum. Il n'est pas souhaitable d'entreprendre une deuxième cure par la triptoréline ou par les autres analogues de la GnRH.
- NB : Il est important que l'injection de la forme à libération prolongée soit pratiquée rigoureusement selon les instructions de la notice. Toute injection défectueuse, conduisant à la perte d'une quantité de la suspension supérieure à celle qui reste normalement dans le dispositif utilisé pour l'injection, doit être signalée.
- Coût du traitement journalier : 4,15 euro(s).
CONTRE-INDICATIONS |
MISES EN GARDE et PRÉCAUTIONS D'EMPLOI |
Mises en garde :
- Cancer de la prostate :
- Mises en garde lors de l'initiation du traitement :
- Des cas isolés d'aggravation, le plus souvent transitoire, des symptômes cliniques (douleurs osseuses en particulier) ont été rapportés lors de la mise en route du traitement.
- Ils justifient une surveillance médicale particulièrement attentive durant les premières semaines du traitement, notamment chez les patients porteurs d'une obstruction des voies excrétrices et chez les malades présentant des métastases vertébrales (cf Effets indésirables).
- Pour la même raison, la mise en route du traitement chez les sujets présentant des signes prémonitoires de compression médullaire doit être soigneusement pesée.
- Une élévation transitoire des phosphatases acides en début de traitement peut être observée.
- Endométriose :
- Il est impératif de vérifier, avant toute prescription de ce médicament, l'absence de grossesse.
- Cancer de la prostate :
- Il peut être utile de vérifier périodiquement, avec une méthode sensible, la testostéronémie, qui ne doit pas être supérieure à 1 ng/ml.
- Endométriose :
- L'administration de Décapeptyl LP 11,25 mg entraîne constamment une aménorrhée hypogonadotrophique. La survenue de métrorragies au cours du traitement en dehors du premier mois est anormale. Elle doit conduire à la vérification du taux d'estradiol plasmatique et, si celui-ci est inférieur à 50 pg/ml, à la recherche d'éventuelles lésions organiques associées.
- Après l'arrêt du traitement, la fonction ovarienne reprend et les premières règles apparaissent environ 134 jours après l'injection. Par conséquent, il est nécessaire de prévoir une contraception dans les 15 jours qui suivent l'arrêt du traitement, soit 3 mois et demi après l'injection.
GROSSESSE et ALLAITEMENT |
Les données actuellement disponibles sur les effets de cette classe de produits au cours de la grossesse sont les suivantes :
- Chez l'animal, les études effectuées n'ont pas mis en évidence d'effet tératogène. En l'absence d'effet tératogène chez l'animal, un effet malformatif dans l'espèce humaine n'est pas attendu. En effet, à ce jour, les substances responsables de malformations dans l'espèce humaine se sont révélées tératogènes chez l'animal au cours d'études bien conduites sur deux espèces.
- En clinique, l'utilisation par mégarde des analogues de la GnRH sur des effectifs limités de grossesses exposées n'a apparemment révélé aucun effet malformatif ou foetotoxique particulier à ce jour. Toutefois, des études complémentaires sont nécessaires pour vérifier les conséquences d'une exposition en cours de grossesse.
Allaitement :
En l'absence de données concernant le passage de ce médicament dans le lait et les effets éventuels sur l'enfant nourri au sein, il ne devra pas être utilisé en cas d'allaitement.
EFFETS INDÉSIRABLES |
- Chez l'homme :
-
- Mise en route du traitement (cf Mises en garde et Précautions d'emploi) :
Une exacerbation des symptômes urinaires, des douleurs osseuses d'origine métastatique ou des symptômes relatifs à une compression médullaire par métastase vertébrale sont parfois observés lors de l'augmentation initiale et transitoire du taux plasmatique de la testostérone en début du traitement. Ces symptômes disparaissent en 1 à 2 semaines.
- En cours de traitement :
Les effets indésirables le plus fréquemment rapportés (bouffées de chaleur, diminution de la libido et impuissance) sont liés à l'abaissement des taux plasmatiques de la testostérone, conséquence de l'action pharmacologique du produit, et sont similaires à ceux observés avec les autres analogues de la GnRH.
- Mise en route du traitement (cf Mises en garde et Précautions d'emploi) :
- Chez la femme :
-
- Mise en route du traitement :
Une exacerbation des symptômes de l'endométriose (douleurs pelviennes, dysménorrhée) peut être observée lors de l'augmentation initiale et transitoire du taux plasmatique d'estradiol, et disparaît en 1 à 2 semaines.
La survenue de métrorragies peut être observée dans le mois suivant la première injection.
- En cours de traitement :
Les effets le plus fréquemment rapportés tels que bouffées de chaleur, sécheresse vaginale, diminution de la libido et dyspareunie sont liés au blocage hypophyso-ovarien.
Plus rarement ont été signalées : céphalées, arthralgies et myalgies.
- Mise en route du traitement :
- Dans les deux sexes :
- Des réactions allergiques à type d'urticaire, de rash, de prurit et d'exceptionnels oedèmes de Quincke ont été signalés.
- Quelques cas de nausées, vomissements, prise de poids, hypertension artérielle, troubles de l'humeur, fièvre, anomalies visuelles et douleur au point d'injection ont été rapportés.
- L'utilisation prolongée des analogues de la GnRH peut induire une perte osseuse, facteur de risque d'une éventuelle ostéoporose.
PHARMACODYNAMIE |
Analogue de l'hormone entraînant la libération de gonadotrophines (L02AE04 : antinéoplasique et immunomodulateur).
- La triptoréline est un décapeptide de synthèse analogue de la GnRH naturelle (hormone de libération des gonadotrophines).
- Les études conduites dans l'espèce humaine comme chez l'animal ont montré que, après une stimulation initiale, l'administration prolongée de triptoréline entraîne une inhibition de la sécrétion gonadotrope, supprimant par conséquent les fonctions testiculaire et ovarienne.
- L'administration de Décapeptyl LP 11,25 mg peut entraîner une élévation initiale des taux sanguins de LH et de FSH, ce qui a pour corollaire une augmentation initiale (« flare-up ») du taux de testostérone chez l'homme et du taux d'estradiol chez la femme. La poursuite du traitement entraîne une diminution des taux de LH et de FSH conduisant à une diminution des taux de testostérone et d'estradiol qui deviennent équivalents à ceux observés après la castration dans un délai d'environ 20 jours après l'injection et pendant toute la période de libération du principe actif. Chez la femme, l'administration prolongée de triptoréline entraîne la suppression de la sécrétion d'estradiol et ainsi une mise au repos du tissu endométriosique.
PHARMACOCINÉTIQUE |
Après injection intramusculaire de Décapeptyl LP 11,25 mg chez des patients (homme ou femme), on observe un pic plasmatique de triptoréline, environ 3 heures après l'injection. Puis, après une phase de décroissance qui se poursuit pendant le premier mois, les taux de triptoréline circulants se maintiennent en plateau jusqu'à la fin du troisième mois suivant l'injection.
SÉCURITE PRÉCLINIQUE |
Les études de toxicologie animale n'ont pas montré de toxicité spécifique de la molécule. Les effets observés sont liés aux propriétés pharmacologiques du produit sur le système endocrinien.
La résorption du produit est complète en 120 jours.
MODALITÉS DE CONSERVATION |
- Durée de conservation :
- 3 ans.
A conserver à une température ne dépassant pas 25 °C.
A injecter juste après la reconstitution de la suspension.
MODALITÉS MANIPULATION/ÉLIMINATION |
La mise en suspension de la poudre dans le solvant spécifique doit être effectuée immédiatement avant l'injection, en agitant le flacon doucement jusqu'à l'obtention d'un mélange laiteux (lire les instructions d'utilisation dans la notice).
- Instructions d'utilisation :
-
- Préparation du patient avant reconstitution du médicament :
-
- Patient allongé, fesse désinfectée.
- Patient allongé, fesse désinfectée.
-
- Reconstitution du médicament :
- La présence de bulles au-dessus du lyophilisat est un aspect normal du produit.
- Casser le haut de l'ampoule (point face à soi).
- Prélever le solvant dans la seringue à l'aide de l'aiguille (cf figure A).
- Oter la capsule verte du flacon de poudre.
- Transférer le solvant dans le flacon de poudre (cf figure B).
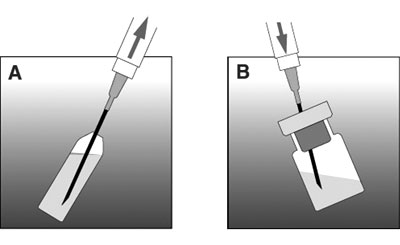
- Remonter l'aiguille au-dessus du niveau du liquide (sans la retirer du flacon ; cf figure C).
- Agiter le temps nécessaire à l'obtention d'un mélange homogène (sans retourner le flacon ; cf figure D).
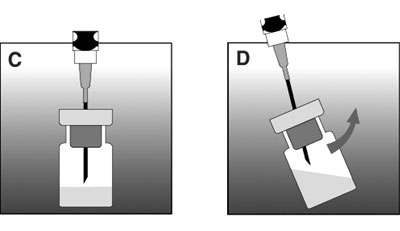
- Vérifier l'absence d'agglomérats avant de prélever la suspension (en cas d'agglomérats, poursuivre l'agitation jusqu'à complète homogénéisation).
- Prélever la totalité du mélange (sans retourner le flacon ; cf figure E).
- Enlever l'aiguille utilisée pour la reconstitution et adapter l'autre aiguille sur la seringue (visser complètement). Ne saisir que la partie colorée pour connecter l'aiguille.
- Purger l'air (cf figure F).
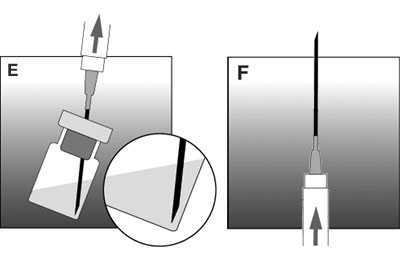
- Casser le haut de l'ampoule (point face à soi).
-
- Injection intramusculaire du médicament :
- Injecter le produit immédiatement dans le muscle fessier.
-
- Après utilisation :
- Jeter les aiguilles dans des containers adaptés.
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| AMM | 3400934125652 (1996, RCP rév 27.07.2010). |
| Prix : | 378.84 euros (flacon + ampoule). |
| Remb Séc soc à 65 %. Collect. | |
IPSEN Pharma
65, quai Georges-Gorse
92100 Boulogne Billancourt
Tél : 01 58 33 50 00. Fax : 01 58 33 50 01
Info médic : Tél : 01 58 33 58 20
