INSULINES SANOFI-AVENTIS APIDRA®
insuline glulisine
FORMES et PRÉSENTATIONS |
Apidra® 100 U/ml en flacon :
Solution injectable (aqueuse, limpide, incolore) : Flacon de 10 ml, boîte unitaire. Apidra® 100 U/ml en cartouche :
Solution injectable SC (aqueuse, limpide, incolore) : Cartouches de 3 ml, boîte de 5. Apidra® 100 U/ml en stylo prérempli SoloStar® :
Solution injectable SC (aqueuse, limpide, incolore) : Cartouches de 3 ml, scellées dans un stylo prérempli jetable (aiguilles non fournies), boîte de 5.
COMPOSITION |
| Apidra en flacon : | p flacon |
| Insuline glulisine* (DCI) | 1000 U |
| (soit 100 U/ml, équivalant à 3,49 mg/ml) | |
| Apidra en cartouche ou en stylo : | p cartouche/p stylo | |
| Insuline glulisine* (DCI) | 300 U | |
| (soit 100 U/ml, équivalant à 3,49 mg/ml) | ||
* produite par la technique de l'ADN recombinant sur Escherichia coli.
INDICATIONS |
POSOLOGIE ET MODE D'ADMINISTRATION |
L'activité du produit est exprimée en unités. Ces unités sont spécifiques à Apidra et ne correspondent ni aux UI ni aux unités utilisées pour les autres analogues de l'insuline. Cf Pharmacodynamie.
Apidra s'utilise dans des schémas qui l'associent soit à une insuline humaine d'action intermédiaire ou d'action prolongée, soit à un analogue de l'insuline d'action prolongée, soit à des hypoglycémiants oraux.
La dose d'Apidra doit être ajustée individuellement.
- Populations particulières :
-
- Insuffisant rénal : les propriétés pharmacocinétiques de l'insuline glulisine sont généralement inchangées chez les patients insuffisants rénaux. Les besoins en insuline peuvent cependant être réduits en cas d'insuffisance rénale (cf Pharmacocinétique).
- Insuffisant hépatique : les propriétés pharmacocinétiques de l'insuline glulisine n'ont pas été évaluées chez les patients ayant une altération de la fonction hépatique. Chez les patients insuffisants hépatiques, les besoins en insuline peuvent être diminués en raison d'une réduction de la néoglucogenèse et d'une réduction du métabolisme de l'insuline.
- Sujet âgé : les données de pharmacocinétique disponibles concernant les sujets âgés atteints de diabète sont limitées. Une altération de la fonction rénale peut provoquer une diminution des besoins en insuline.
- Population pédiatrique : les informations cliniques sont insuffisantes concernant l'utilisation d'Apidra chez l'enfant de moins de 6 ans.
- Insuffisant rénal : les propriétés pharmacocinétiques de l'insuline glulisine sont généralement inchangées chez les patients insuffisants rénaux. Les besoins en insuline peuvent cependant être réduits en cas d'insuffisance rénale (cf Pharmacocinétique).
Mode d'administration :
- Voie intraveineuse (Apidra en flacon) :
- Apidra peut être administré par voie intraveineuse. Cela doit être réalisé par des professionnels de santé.
- Apidra ne doit pas être mélangé avec une solution de glucose ou de Ringer ou avec une autre insuline.
- Voie sous-cutanée :
- Apidra doit être administré en injection sous-cutanée un peu avant (0-15 minutes) ou juste après les repas ou en perfusion sous-cutanée continue par pompe.
- Apidra doit être administré en injection sous-cutanée dans la paroi abdominale, la cuisse ou la région deltoïde ou par perfusion continue dans la paroi abdominale. Dans une même zone d'injection (abdomen, cuisse ou deltoïde), il convient de varier, d'une injection à l'autre, les sites d'injection et les sites de perfusion. Le taux d'absorption et, par conséquent, le début et la durée d'action peuvent être modifiés par le site d'injection, par l'exercice physique et par d'autres facteurs. L'injection sous-cutanée dans la paroi abdominale entraîne une absorption légèrement plus rapide qu'à partir des autres sites d'injection (cf Pharmacocinétique).
- Il faut s'assurer de ne pas pénétrer dans un vaisseau sanguin. Après l'injection, il ne faut pas masser le site d'injection. Les patients doivent être éduqués sur les bonnes techniques d'injection.
- Apidra en flacon : en cas d'utilisation dans une pompe à perfusion sous-cutanée d'insuline, Apidra ne doit pas être mélangé à des diluants ou à aucune autre insuline.
- Mélange avec des insulines :
-
- En cas d'administration par injection sous-cutanée, Apidra ne doit pas être mélangée avec d'autres médicaments, sauf avec l'insuline humaine NPH.
-
- Apidra en cartouche et en flacon :
- Pour d'autres précisions sur la manipulation, cf Modalités Manipulation/Élimination.
-
- Apidra en stylo SoloStar :
- Les instructions d'utilisation mentionnées dans la notice doivent être lues avec attention avant toute utilisation de SoloStar (cf Modalités Manipulation/Élimination).
CONTRE-INDICATIONS |
- Hypersensibilité à la substance active ou à l'un des excipients.
- Hypoglycémie.
MISES EN GARDE et PRÉCAUTIONS D'EMPLOI |
- Tout changement de type d'insuline ou de marque d'insuline doit se faire sous strict contrôle médical. Le changement de concentration, de marque (fabricant), de type d'insuline (rapide, Neutral Protamine Hagedorn [NPH], lente, à durée d'action prolongée, etc.), d'origine (animale, humaine, analogue de l'insuline humaine) et/ou de méthode de fabrication peut nécessiter une adaptation des doses. Il peut être nécessaire d'adapter un traitement antidiabétique oral associé.
- L'utilisation de doses inadaptées ou l'arrêt du traitement, en particulier chez le diabétique insulinodépendant, peuvent entraîner une hyperglycémie ou une acidocétose diabétique, situations qui sont potentiellement létales.
- Hypoglycémie :
Le moment de survenue d'une hypoglycémie dépend du profil d'action des insulines utilisées et peut donc varier lorsque le schéma thérapeutique est modifié.
Les circonstances qui peuvent modifier ou atténuer les symptômes précurseurs de l'hypoglycémie sont l'ancienneté du diabète, une insulinothérapie intensifiée, une neuropathie diabétique, des médicaments tels que les bêtabloquants ou le passage d'une insuline d'origine animale à une insuline humaine. Un ajustement de dose peut aussi être nécessaire si le patient augmente son activité physique ou modifie son régime alimentaire. L'exercice physique réalisé immédiatement après un repas peut augmenter le risque d'hypoglycémie.
La survenue d'une éventuelle hypoglycémie peut être plus précoce après une injection d'analogues d'action rapide qu'après une injection d'insuline humaine soluble.
Les réactions hypoglycémiques ou hyperglycémiques non corrigées peuvent entraîner une perte de conscience, un coma ou la mort.
Les besoins en insuline peuvent être modifiés au cours d'une maladie ou par des troubles émotionnels.
- Erreurs médicamenteuses : des erreurs médicamenteuses ont été rapportées au cours desquelles d'autres insulines, en particulier des insulines d'action prolongée, ont été accidentellement administrées à la place de l'insuline glulisine. L'étiquette de l'insuline doit toujours être vérifiée avant chaque injection pour éviter les erreurs médicamenteuses entre l'insuline glulisine et d'autres insulines.
- Ce médicament contient moins de 1 mmol (23 mg) de sodium par dose ; il est donc considéré comme sans sodium.
- Apidra contient du métacrésol, qui peut entraîner des réactions allergiques.
- Association d'Apidra avec la pioglitazone : des cas d'insuffisance cardiaque ont été rapportés lorsque la pioglitazone est associée à l'insuline, en particulier chez les patients ayant des facteurs de risque de développement d'une insuffisance cardiaque. Il faut en tenir compte si un traitement associant Apidra avec la pioglitazone est envisagé. Si l'association est utilisée, il est recommandé de surveiller les signes et symptômes d'insuffisance cardiaque, de prise de poids et d'oedème. La pioglitazone doit être arrêtée devant toute apparition d'une dégradation des symptômes cardiaques.
- Stylos utilisables avec les cartouches Apidra : les cartouches Apidra doivent être utilisées uniquement avec les stylos suivants : OptiPen, ClikStar, Tactipen et Autopen 24 et ne doivent être utilisées avec aucun autre stylo réutilisable puisque la précision de la dose a été établie uniquement avec les stylos précités.
- Manipulation du stylo Apidra SoloStar : les instructions d'utilisation mentionnées dans la notice doivent être lues avec attention avant toute utilisation de SoloStar. SoloStar doit être utilisé tel que recommandé dans ces instructions d'utilisation (cf Modalités de manipulation et d'élimination).
INTERACTIONS |
Aucune étude concernant les interactions d'origine pharmacocinétique n'a été réalisée. D'après les connaissances empiriques sur des produits similaires, la survenue d'interactions d'origine pharmacocinétique cliniquement pertinentes est peu probable.
Plusieurs substances influencent le métabolisme glucidique et peuvent nécessiter une adaptation de la posologie de l'insuline glulisine et une surveillance particulièrement rigoureuse.
Les substances susceptibles de potentialiser l'activité hypoglycémiante et d'augmenter la sensibilité à l'hypoglycémie comprennent les antidiabétiques oraux, les inhibiteurs de l'enzyme de conversion de l'angiotensine (IEC), le disopyramide, les fibrates, la fluoxétine, les inhibiteurs de la monoamine-oxydase (IMAO), la pentoxifylline, le propoxyphène, les salicylates et les sulfamides antibactériens.
Les substances qui peuvent réduire l'activité hypoglycémiante comprennent les corticoïdes, le danazol, le diazoxide, les diurétiques, le glucagon, l'isoniazide, les dérivés de la phénothiazine, la somatotropine, les sympathomimétiques (par exemple, épinéphrine [adrénaline], salbutamol, terbutaline), les hormones thyroïdiennes, les estrogènes, les progestatifs (dans les contraceptifs oraux, par exemple), les inhibiteurs de protéase et les antipsychotiques atypiques (olanzapine et clozapine, par exemple).
Les bêtabloquants, la clonidine, les sels de lithium ou l'alcool peuvent potentialiser ou réduire l'activité hypoglycémiante de l'insuline. La pentamidine peut provoquer une hypoglycémie, parfois suivie d'une hyperglycémie.
De plus, sous l'influence de produits sympatholytiques tels que les bêtabloquants, la clonidine, la guanéthidine et la réserpine, les signes de réaction adrénergique compensatrice peuvent être atténués, voire absents.
FERTILITÉ/GROSSESSE/ALLAITEMENT |
Il n'existe pas de données suffisantes concernant l'utilisation de l'insuline glulisine chez la femme enceinte.
Les études de reproduction chez l'animal n'ont révélé aucune différence entre l'insuline glulisine et l'insuline humaine en ce qui concerne la gestation, le développement embryonnaire/foetal, l'accouchement ou le développement postnatal (cf Sécurité préclinique).
La prudence s'impose lors de la prescription chez la femme enceinte. Une surveillance rigoureuse du contrôle glycémique est essentielle.
En cas de diabète préexistant ou de diabète gestationnel, il faut impérativement maintenir un bon contrôle métabolique durant toute la grossesse. Les besoins en insuline peuvent diminuer durant le premier trimestre et augmentent généralement durant le second et le troisième trimestre. Immédiatement après l'accouchement, les besoins en insuline diminuent rapidement.
Allaitement :
L'excrétion de l'insuline glulisine dans le lait humain est inconnue, mais de façon générale l'insuline ne passe pas dans le lait maternel et n'est pas absorbée après administration orale.
Une adaptation de la dose d'insuline et du régime alimentaire peut s'avérer nécessaire pendant l'allaitement.
CONDUITE et UTILISATION DE MACHINES |
Les patients doivent être informés des précautions à prendre avant de conduire pour éviter une hypoglycémie, en particulier si les symptômes précurseurs d'hypoglycémie sont diminués ou absents, ou si les épisodes d'hypoglycémie sont fréquents. Dans de telles circonstances, la capacité à conduire doit être évaluée.
EFFETS INDÉSIRABLES |
Les effets indésirables rapportés lors des études cliniques sont listés ci-dessous, classés par système organe, dans un ordre décroissant en terme d'incidence : très fréquent >= 1/10 ; fréquent >= 1/100, < 1/10 ; peu fréquent >= 1/1000, < 1/100 ; rare >= 1/10 000, < 1/1000 ; très rare < 1/10 000 ; fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Au sein de chaque fréquence de groupe, les effets indésirables doivent être présentés suivant un ordre décroissant de gravité.
- Troubles du métabolisme et de la nutrition :
-
- Très fréquent : hypoglycémie.
Les symptômes de l'hypoglycémie apparaissent en général subitement. Ils incluent sueurs froides, pâleur, fatigue, nervosité ou tremblement, anxiété, épuisement ou faiblesse inhabituels, confusion, difficulté de concentration, somnolence, faim intense, troubles de la vision, céphalée, nausées et palpitations.
L'hypoglycémie peut s'aggraver et entraîner une perte de la conscience et/ou des convulsions et peut conduire à une altération réversible ou non de la fonction cérébrale, voire à la mort.
- Très fréquent : hypoglycémie.
- Affections de la peau et des tissus sous-cutanés :
-
- Fréquent : réactions au site d'injection et réactions d'hypersensibilité locale.
Des réactions d'hypersensibilité locale (rougeur, gonflement et démangeaison au point d'injection) peuvent survenir pendant le traitement avec l'insuline. Ces réactions sont en général transitoires et elles disparaissent normalement au cours du traitement.
- Rare : lipodystrophie.
Une lipodystrophie peut apparaître au site d'injection si le changement du site d'injection dans une même zone d'injection n'est pas respecté.
- Fréquent : réactions au site d'injection et réactions d'hypersensibilité locale.
- Troubles généraux et anomalies au site d'administration :
-
- Peu fréquent : réactions d'hypersensibilité systémique.
Les réactions d'hypersensibilité systémique peuvent se manifester par de l'urticaire, une oppression thoracique, une dyspnée, un eczéma allergique et un prurit. Les cas d'allergie généralisée grave, dont le choc anaphylactique, peuvent engager le pronostic vital.
- Peu fréquent : réactions d'hypersensibilité systémique.
SURDOSAGE |
- Une hypoglycémie peut résulter d'un excès d'insuline par rapport à l'alimentation et à la dépense énergétique.
- Il n'existe aucune donnée spécifique disponible concernant le surdosage en insuline glulisine. Cependant, une hypoglycémie peut comporter différents stades :
- Les épisodes d'hypoglycémie légère seront traités par ingestion de glucose ou de produits sucrés. Il est donc recommandé au patient diabétique de disposer en permanence de morceaux de sucre, bonbons, biscuits ou jus de fruit sucré.
- Les épisodes hypoglycémiques sévères, accompagnés d'une perte de connaissance, seront traités par du glucagon (0,5 mg à 1 mg) administré par voie intramusculaire ou sous-cutanée par une personne spécifiquement formée, ou par du glucose administré par voie intraveineuse par un professionnel de santé. Si le patient ne répond pas au glucagon dans les 10 à 15 minutes, du glucose doit être administré par voie intraveineuse.
- Lors de la reprise de conscience, l'administration d'hydrates de carbone par voie orale est recommandée afin d'éviter une récidive.
- Après une injection de glucagon, le patient doit être suivi en milieu hospitalier afin d'identifier la raison de cette hypoglycémie sévère et de prévenir d'autres épisodes similaires.
- Les épisodes d'hypoglycémie légère seront traités par ingestion de glucose ou de produits sucrés. Il est donc recommandé au patient diabétique de disposer en permanence de morceaux de sucre, bonbons, biscuits ou jus de fruit sucré.
PHARMACODYNAMIE |
Classe pharmacothérapeutique : insuline et ses analogues injectables, d'action rapide (code ATC : A10AB06).
L'insuline glulisine est un analogue recombinant de l'insuline humaine, de puissance équivalente à l'insuline rapide humaine. L'insuline glulisine a un début d'action plus précoce et une durée d'action plus courte que l'insuline rapide humaine.
L'insuline et ses analogues, comme l'insuline glulisine, régulent le métabolisme glucidique. Les insulines diminuent la glycémie en stimulant la captation périphérique du glucose, en particulier par le muscle squelettique et par le tissu adipeux et en inhibant la production hépatique de glucose. L'insuline inhibe la lipolyse dans l'adipocyte, inhibe la protéolyse et favorise la synthèse des protéines.
Les études chez les volontaires sains et chez les patients diabétiques ont démontré que l'insuline glulisine a un début d'action plus précoce et une durée d'action plus courte que l'insuline rapide humaine lorsqu'elle est administrée par voie sous-cutanée. Après injection sous-cutanée d'insuline glulisine, l'activité hypoglycémiante débute dans les 10 à 20 minutes.
Apidra en flacon : Après administration intraveineuse, un début d'action plus rapide et une durée d'action plus courte, de même qu'un pic d'action plus élevé ont été observés en comparaison à une administration sous-cutanée.
Les activités hypoglycémiantes de l'insuline glulisine et de l'insuline rapide humaine sont équipotentes en cas d'administration par voie intraveineuse. Une unité d'insuline glulisine est dotée de la même activité hypoglycémiante qu'une unité d'insuline rapide humaine.
- Effet dose :
- Dans une étude avec 18 sujets masculins diabétiques de type 1, âgés de 21 à 50 ans, l'effet hypoglycémiant de l'insuline glulisine a été proportionnel à la dose dans l'intervalle de doses thérapeutiques allant de 0,075 à 0,15 Unités/kg. A partir de doses de 0,3 Unités/kg, comme avec l'insuline humaine, l'effet hypoglycémiant observé a été moindre que celui qui aurait été attendu si l'effet avait été proportionnel à la dose.
- L'effet de l'insuline glulisine est environ deux fois plus rapide que l'insuline rapide humaine et se termine deux heures plus tôt que l'insuline rapide humaine.
Une étude de phase I chez des patients diabétiques de type 1 a évalué les profils hypoglycémiants de l'insuline glulisine et de l'insuline rapide humaine administrées par voie sous-cutanée à la dose de 0,15 Unités/kg, à différents temps par rapport à un repas standard de 15 minutes. Les données ont montré que l'insuline glulisine administrée 2 minutes avant le repas assure un contrôle glycémique postprandial comparable à l'insuline rapide humaine administrée 30 minutes avant le repas. Administrée 2 minutes avant le repas, l'insuline glulisine assure un meilleur contrôle postprandial que l'insuline rapide humaine administrée 2 minutes avant le repas. L'insuline glulisine administrée 15 minutes après le début du repas entraîne un contrôle glycémique comparable à l'insuline rapide humaine administrée 2 minutes avant le repas (voir Figure 1).
- Figure 1 : Effet hypoglycémiant moyen sur 6 heures chez 20 patients diabétiques de type 1. Insuline glulisine administrée 2 minutes (GLULISINE pré) avant le début d'un repas comparée à l'insuline rapide humaine administrée 30 minutes (RAPIDE 30 min) avant le début du repas (figure 1A) et comparée à l'insuline rapide humaine administrée 2 minutes (RAPIDE pré) avant un repas (figure 1B). Insuline glulisine administrée 15 minutes (GLULISINE post) après le début d'un repas comparée à l'insuline rapide humaine administrée 2 minutes (RAPIDE pré) avant le début du repas (figure 1C). Sur l'axe des abscisses, le zéro (flèche) indique le début d'un repas de 15 minutes.
-
Figure 1A 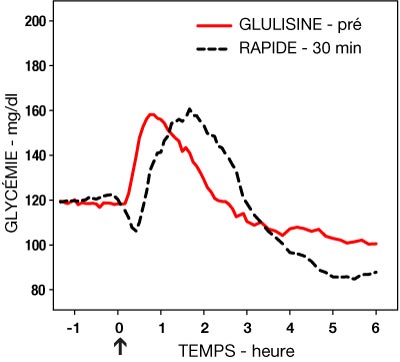
-
Figure 1B 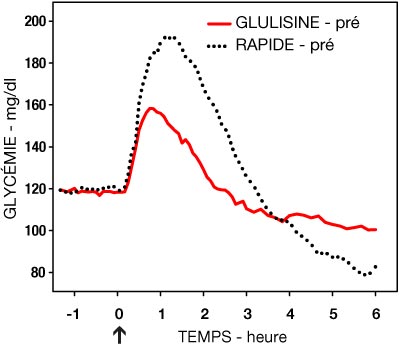
-
Figure 1C 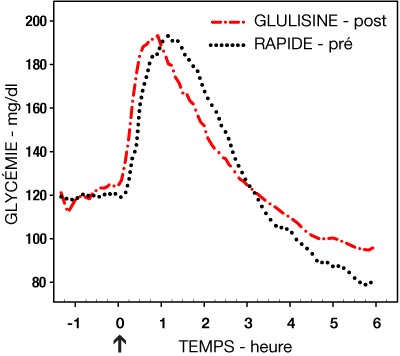
- Obésité :
- Une étude de phase I réalisée avec l'insuline glulisine, l'insuline lispro et l'insuline rapide humaine dans une population obèse a démontré que l'insuline glulisine conserve ses propriétés d'action rapide. Dans cette étude, le temps nécessaire pour atteindre 20 % de l'ASC [aire sous la courbe] totale et l'ASC (0-2 h) représentant l'activité hypoglycémiante précoce ont été respectivement de 114 minutes et 427 mg/kg pour l'insuline glulisine, 121 minutes et 354 mg/kg pour l'insuline lispro, 150 minutes et 197 mg/kg pour l'insuline rapide humaine (voir Figure 2).
-
Figure 2 : Vitesse de perfusion du glucose après injection sous-cutanée de 0,3 Unités/kg d'insuline glulisine (GLULISINE) ou d'insuline lispro (LISPRO) ou d'insuline rapide humaine (RAPIDE) dans une population obèse. 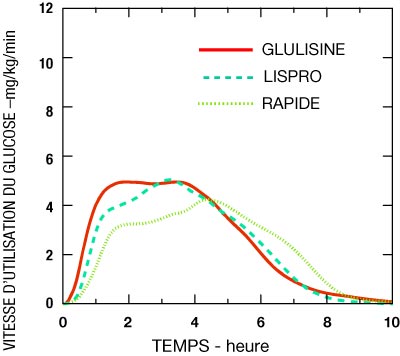
- Une autre étude de phase I réalisée avec l'insuline glulisine et l'insuline lispro dans une population non diabétique (80 sujets) avec un large intervalle d' IMC (18-46 kg/m2) a démontré que la rapidité d'action est généralement maintenue dans ce large intervalle d'indice de masse corporelle (IMC), même si l'effet hypoglycémiant total diminue avec l'augmentation de l'obésité.
- L'ASC (aire sous la courbe) moyenne totale (entre 0 et 1 heure) de la vitesse de perfusion du glucose était respectivement de 102 mg/kg ± 75 et 158 mg/kg ± 100 avec 0,2 et 0,4 Unités/kg d'insuline glulisine, et respectivement de 83,1 mg/kg ± 72,8 et 112,3 mg/kg ± 70,8 avec 0,2 et 0,4 Unités/kg d'insuline lispro.
- Une étude de phase I chez 18 patients obèses diabétiques de type 2 (IMC compris entre 35 et 40 kg/m2) avec l'insuline glulisine et l'insuline lispro [IC 90 % : 0,81-0,95 (p <= 0,01)] a montré que l'insuline glulisine contrôle efficacement les excursions glycémiques postprandiales diurnes.
- Études cliniques :
-
- Diabète de type 1 chez l'adulte :
- Dans une étude clinique de phase III sur 26 semaines comparant l'insuline glulisine et l'insuline lispro, toutes deux injectées par voie sous-cutanée peu avant un repas (0-15 minutes) chez des patients diabétiques de type 1 utilisant l'insuline glargine comme insuline basale, l'insuline glulisine s'est avérée comparable à l'insuline lispro pour le contrôle glycémique, comme démontré par les variations de l'hémoglobine glyquée (exprimée en équivalent HbA1c) entre le début et la fin de l'étude. Des valeurs comparables d'autosurveillance glycémique ont été observées. Aucune augmentation de la dose d'insuline basale n'a été nécessaire avec l'insuline glulisine, contrairement à l'insuline lispro.
- Une étude clinique de phase III sur 12 semaines, réalisée chez des patients diabétiques de type 1 recevant de l'insuline glargine comme insuline basale, indique que l'administration postprandiale immédiate d'insuline glulisine assure une efficacité comparable à l'insuline glulisine préprandiale immédiate (0-15 minutes) ou à l'insuline rapide (30-45 minutes).
- Dans la population per protocole, la réduction observée de l'hémoglobine glyquée a été significativement plus importante dans le groupe glulisine préprandiale que dans le groupe insuline rapide.
-
- Diabète de type 1 en pédiatrie :
- Une étude clinique de phase III sur 26 semaines a comparé l'insuline glulisine et l'insuline lispro toutes deux injectées par voie sous-cutanée peu avant un repas (0-15 minutes) chez des enfants (4-5 ans : n = 9 ; 6-7 ans : n = 32 ; 8-11 ans : n = 149) et des adolescents (12-17 ans : n = 382) diabétiques de type 1 utilisant l'insuline glargine ou la NPH comme insuline basale. L'insuline glulisine s'est avérée comparable à l'insuline lispro en termes de contrôle glycémique, comme démontré par les variations de l'hémoglobine glyquée (exprimée en équivalent HbA1c) entre le début et la fin de l'étude et par les valeurs de glycémies recueillies par autosurveillance.
- Les informations cliniques sont insuffisantes concernant l'utilisation d'Apidra chez l'enfant de moins de 6 ans.
-
- Diabète de type 2 chez l'adulte :
- Une étude clinique de phase III sur 26 semaines, prolongée d'une étude de la tolérance sur 26 semaines, a été réalisée pour comparer l'insuline glulisine (0-15 minutes avant un repas) à l'insuline rapide humaine (30-45 minutes avant un repas) injectées par voie sous-cutanée chez des sujets diabétiques de type 2 utilisant aussi une insuline NPH comme insuline basale. L'indice de masse corporelle moyen (IMC) des patients était de 34,55 kg/m2. L'insuline glulisine s'est avérée comparable à l'insuline rapide humaine en termes de variations de l'hémoglobine glyquée (exprimée en équivalent HbA1c) entre le début de l'étude et à 6 mois (- 0,46 % pour l'insuline glulisine et - 0,30 % pour l'insuline rapide humaine, p = 0,0029) et entre le début de l'étude et à 12 mois (- 0,23 % pour l'insuline glulisine et - 0,13 % pour l'insuline rapide humaine, sans différence significative). Dans cette étude, la majorité des patients (79 %) mélangeait leur insuline d'action rapide à l'insuline NPH immédiatement avant l'injection et 58 % des sujets utilisaient des hypoglycémiants oraux à l'inclusion et avaient pour consigne de les poursuivre à la même dose.
-
- Race et sexe :
- Dans les essais cliniques contrôlés chez l'adulte, aucune différence de tolérance et d'efficacité de l'insuline glulisine n'a été mise en évidence dans les analyses de sous-groupes portant sur la race et le sexe.
PHARMACOCINÉTIQUE |
La substitution de l'acide aspartique en position B3 de l'insuline humaine par la lysine, et de la lysine en position B29 par l'acide glutamique favorise l'absorption plus rapide de l'insuline glulisine.
Dans une étude avec 18 sujets masculins diabétiques de type 1, âgés de 21 à 50 ans, l'effet de l'insuline glulisine (exposition précoce, maximale et totale) a été proportionnel à la dose dans l'intervalle de doses allant de 0,075 à 0,4 Unités/kg.
- Absorption et biodisponibilité :
- Les profils pharmacocinétiques chez les volontaires sains et des patients diabétiques (type 1 ou 2) ont démontré que l'absorption de l'insuline glulisine était environ deux fois plus rapide avec un pic de concentration approximativement deux fois plus élevé comparativement à l'insuline rapide humaine.
- Dans une étude chez des patients diabétiques de type 1 après administration sous-cutanée de 0,15 Unités/kg, pour l'insuline glulisine le Tmax était de 55 minutes et la Cmax de 82 µUnités/ml ± 1,3 versus un Tmax de 82 minutes et une Cmax de 46 µUnités/ml ± 1,3 pour l'insuline rapide humaine. Le temps moyen de résidence de l'insuline glulisine était plus court (98 minutes) que pour l'insuline rapide humaine (161 minutes) : voir Figure 3.
-
Figure 3 : Profil pharmacocinétique de l'insuline glulisine et de l'insuline rapide humaine chez des patients diabétiques de type 1 après une dose de 0,15 Unités/kg. 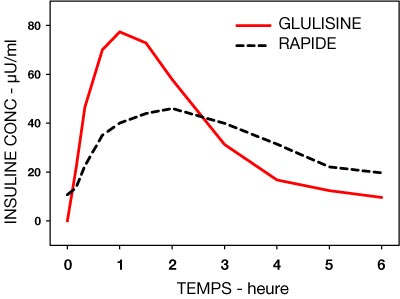
- Dans une étude chez des patients diabétiques de type 2 après administration sous-cutanée de 0,2 Unités/kg d'insuline glulisine, la Cmax était de 91 µUnités/ml avec un intervalle interquartile allant de 78 à 104 µUnités/ml.
- Les profils de concentration en fonction du temps étaient comparables, que l'insuline glulisine ait été injectée par voie sous-cutanée dans l'abdomen, le deltoïde ou la cuisse, avec une absorption légèrement plus rapide en cas d'administration dans l'abdomen comparativement à la cuisse. L'absorption après injection dans la région deltoïde était intermédiaire (cf Posologie et Mode d'administration). La biodisponibilité absolue (70 %) de l'insuline glulisine était similaire entre les sites d'injection et sa variabilité intra-individuelle était faible (CV = 11 %). L'administration en bolus intraveineux d'insuline glulisine entraîne une exposition systémique plus élevée comparée à une injection sous-cutanée, avec une Cmax approximativement 40 fois supérieure.
- Obésité :
- Une autre étude de phase I réalisée avec l'insuline glulisine et l'insuline lispro dans une population non diabétique (80 sujets) avec un large intervalle d'IMC (18-46 kg/m2) a démontré que la rapidité d'absorption et l'exposition totale sont généralement maintenues dans ce large intervalle d'IMC.
- Le temps correspondant à 10 % d'exposition totale à l'insuline est atteint plus précocement, de 5 à 6 minutes approximativement, avec l'insuline glulisine.
- Distribution et élimination :
- Après administration intraveineuse, la distribution et l'élimination de l'insuline glulisine et de l'insuline rapide humaine sont comparables avec respectivement des volumes de distribution de 13 l et 22 l et des demi-vies de 13 et 18 minutes.
- Après administration sous-cutanée, l'insuline glulisine est éliminée plus rapidement que l'insuline rapide humaine avec une demi-vie apparente de 42 minutes versus 86 minutes. La demi-vie apparente de l'insuline glulisine était comprise entre 37 et 75 minutes (intervalle interquartile) dans une analyse transversale d'études conduites chez des sujets sains et chez des patients diabétiques de type 1 ou de type 2.
- L'insuline glulisine montre une faible liaison aux protéines plasmatiques, similaire à l'insuline humaine.
- Populations particulières :
-
- Insuffisant rénal : Dans une étude clinique réalisée chez des sujets non diabétiques couvrant différents niveaux de fonction rénale (Clcr > 80 ml/min, 30-50 ml/min, < 30 ml/min), les propriétés d'action rapide de l'insuline glulisine ont été généralement conservées. Cependant, les besoins en insuline peuvent être réduits en cas d'insuffisance rénale.
- Insuffisant hépatique : Les propriétés pharmacocinétiques n'ont pas été étudiées chez des patients présentant une fonction hépatique altérée.
- Sujet âgé : Les données de pharmacocinétique disponibles concernant les patients âgés diabétiques sont très limitées.
- Enfant et adolescent : Les propriétés pharmacocinétiques et pharmacodynamiques de l'insuline glulisine ont été étudiées chez les enfants (7-11 ans) et les adolescents (12-16 ans) diabétiques de type 1. L'insuline glulisine était rapidement absorbée dans les deux groupes d'âge avec des Tmax et Cmax comparables à ceux observés chez l'adulte (cf Posologie et Mode d'administration). Comme chez l'adulte, l'insuline glulisine, administrée juste avant le repas, permettait un meilleur contrôle postprandial que l'insuline rapide humaine (cf Pharmacodynamie). L'excursion glycémique (ASC0-6 h) était de 641 mg × h/dl pour l'insuline glulisine et de 801 mg × h/dl pour l'insuline rapide humaine.
- Insuffisant rénal : Dans une étude clinique réalisée chez des sujets non diabétiques couvrant différents niveaux de fonction rénale (Clcr > 80 ml/min, 30-50 ml/min, < 30 ml/min), les propriétés d'action rapide de l'insuline glulisine ont été généralement conservées. Cependant, les besoins en insuline peuvent être réduits en cas d'insuffisance rénale.
SÉCURITE PRÉCLINIQUE |
Les données non cliniques n'ont pas révélé de résultats de toxicité qui diffèrent de ceux de l'insuline rapide humaine ou qui soient cliniquement pertinents chez l'homme, autres que ceux liés à l'activité pharmacodynamique hypoglycémiante (hypoglycémie).
INCOMPATIBILITÉS |
En l'absence d'études de compatibilité, l'insuline glulisine ne doit pas être mélangée avec d'autres médicaments, sauf avec l'insuline humaine NPH.
- Apidra en flacon :
-
- Voie sous-cutanée :
- En cas d'utilisation dans une pompe à perfusion, Apidra ne doit pas être mélangé avec d'autres médicaments.
-
- Voie intraveineuse :
- Apidra est incompatible avec une solution de glucose à 5 % et une solution de Ringer. Par conséquent, il ne doit pas être utilisé avec ces solutions. L'utilisation avec d'autres solutions n'a pas été étudiée.
CONDITIONS DE CONSERVATION |
- Avant ouverture :
- A conserver au réfrigérateur (entre 2 °C et 8 °C). Conserver le flacon, la cartouche ou le stylo prérempli dans l'emballage extérieur, à l'abri de la lumière.
- Ne pas congeler.
- Ne pas mettre Apidra à côté du compartiment congélateur ou d'une poche de congélation.
- En cours d'utilisation :
-
- Durée de conservation après la première utilisation du flacon, de la cartouche ou du stylo :
- Le produit peut être conservé jusqu'à 4 semaines maximum, à une température ne dépassant pas 25 °C, à l'abri de la chaleur directe ou de la lumière directe.
-
- Flacon :
- A conserver dans l'emballage extérieur, à l'abri de la lumière. Il est recommandé d'inscrire la date de première utilisation du flacon sur l'étiquette.
- Durée de conservation par voie intraveineuse : l'insuline glulisine par voie intraveineuse à la concentration de 1 Unité/ml est stable entre 15 °C et 25 °C pendant 48 heures (cf Modalités de manipulation et d'élimination).
-
- Cartouches et stylos :
- Ne pas conserver les stylos contenant une cartouche ou les stylos en cours d'utilisation au réfrigérateur. Le capuchon du stylo doit être remis sur le stylo après chaque injection afin de le protéger de la lumière.
MODALITÉS MANIPULATION/ÉLIMINATION |
Examiner les flacons, les cartouches et les stylos avant l'emploi. Ne les utiliser que si la solution est limpide, incolore, sans particules solides visibles et a l'aspect de l'eau. Apidra est une solution, elle ne nécessite pas une remise en suspension avant emploi.
L'étiquette de l'insuline doit toujours être vérifiée avant chaque injection pour éviter les erreurs médicamenteuses entre l'insuline glulisine et d'autres insulines (cf Mises en garde et Précautions d'emploi).
- Mélange avec des insulines :
- Lors du mélange avec une insuline humaine NPH, Apidra doit être prélevé dans la seringue en premier. L'injection doit être faite immédiatement après le mélange car aucune donnée n'est disponible sur les mélanges préparés un certain temps avant l'injection.
- Apidra en flacon :
-
- Voie sous-cutanée :
- Les flacons d'Apidra sont utilisés avec des seringues à insuline portant une graduation adéquate ou avec une pompe à insuline (cf Posologie et Mode d'administration).
- Perfusion sous-cutanée continue par pompe :
- Apidra peut être administré par perfusion sous-cutanée continue d'insuline (CSII) à l'aide d'une pompe à perfusion d'insuline avec des cathéters et des réservoirs adaptés.
- Les patients traités par CSII doivent être clairement informés sur l'utilisation de la pompe. Le matériel de perfusion et le réservoir doivent être changés toutes les 48 heures en respectant les règles d'asepsie.
- Lorsqu'Apidra est administré par CSII, les patients doivent disposer d'une autre source d'insuline qu'ils utiliseront en cas de panne de la pompe.
-
- Voie intraveineuse :
- Dans les systèmes de perfusion, Apidra doit être utilisé à une concentration de 1 Unité/ml d'insuline glulisine diluée dans du chlorure de sodium à 9 mg/ml (0,9 %) avec ou sans 40 mmol/l de chlorure de potassium. Le système de perfusion est une poche de perfusion en plastique (polyoléfine/polyamide) avec une tubulure de perfusion adaptée. La solution pour perfusion intraveineuse contenant l'insuline glulisine à une concentration de 1 Unité/ml est stable 48 heures à température ambiante.
- Après dilution pour utilisation par voie intraveineuse, la solution doit être examinée visuellement avant l'administration pour rechercher des particules. Elle doit être utilisée uniquement si la solution est limpide et incolore. Ne pas utiliser si elle est trouble ou si elle présente des particules visibles.
- Apidra en cartouche :
- Les cartouches Apidra doivent être utilisées uniquement avec OptiPen, ClikStar, Autopen 24 ou Tactipen (cf Mises en garde et Précautions d'emploi). Tous ces stylos peuvent ne pas être commercialisés dans un pays.
- Le stylo doit être utilisé conformément aux instructions du fabricant du dispositif.
- Les instructions du fabricant pour l'utilisation du stylo doivent être soigneusement suivies pour l'insertion de la cartouche, la fixation de l'aiguille et l'injection d'insuline. Avant l'insertion de la cartouche dans le stylo réutilisable, la cartouche doit être conservée à température ambiante 1 à 2 heures. Les bulles d'air doivent être éliminées de la cartouche avant l'injection (voir les instructions d'utilisation du stylo). Les cartouches vides ne doivent pas être reremplies.
- En cas de mauvais fonctionnement du stylo (voir le mode d'emploi du stylo), la solution peut être prélevée de la cartouche à l'aide d'une seringue (adaptée à une insuline concentrée à 100 U/ml) et injectée.
- Si le stylo injecteur d'insuline est défectueux ou ne fonctionne pas correctement (dû à des défauts mécaniques), il doit être écarté et un nouveau stylo à insuline doit être utilisé.
- Afin de prévenir tout risque de contamination, le stylo réutilisable ne doit être utilisé que par un seul patient.
- Apidra en stylo prérempli SoloStar :
- Avant la première utilisation, il faut conserver le stylo à température ambiante pendant 1 à 2 heures.
- Les stylos vides ne doivent jamais être réutilisés et devront être éliminés de manière appropriée.
- Afin de prévenir toute contamination, l'utilisation d'un stylo prérempli doit être strictement réservée à un seul et même patient.
-
- Manipulation du stylo :
- Il doit être conseillé aux patients de lire avec attention les instructions d'utilisation mentionnées dans la notice avant toute utilisation de SoloStar.
- Informations importantes pour l'utilisation de SoloStar :
- Avant chaque utilisation, une aiguille neuve doit toujours être soigneusement fixée et un test de sécurité doit être effectué. Utiliser uniquement des aiguilles approuvées pour être utilisées avec SoloStar.
- Prendre des précautions particulières afin d'éviter toute blessure accidentelle avec l'aiguille et tout risque de transmission infectieuse.
- SoloStar ne doit jamais être utilisé s'il est endommagé ou si le patient n'est pas certain qu'il fonctionne correctement.
- Le patient doit toujours disposer d'un SoloStar de rechange au cas où le le SoloStar serait endommagé ou égaré.
- Instructions de conservation : Se reporter à la rubrique Conditions de conservation pour les instructions de SoloStar.
Si SoloStar est conservé dans un endroit frais, il doit être sorti 1 à 2 heures avant l'injection afin de le réchauffer. L'injection d'une insuline qui n'est pas à température ambiante est plus douloureuse.
Un SoloStar usagé doit être éliminé conformément aux recommandations des autorités locales.
- Avant chaque utilisation, une aiguille neuve doit toujours être soigneusement fixée et un test de sécurité doit être effectué. Utiliser uniquement des aiguilles approuvées pour être utilisées avec SoloStar.
-
- Entretien :
- SoloStar doit être protégé de la poussière et de la saleté.
- L'extérieur de votre SoloStar peut être nettoyé en l'essuyant avec un linge humide.
- Le stylo ne doit pas être trempé, ni lavé ou lubrifié car cela risquerait de l'endommager.
- SoloStar a été conçu pour fonctionner avec précision et en toute sécurité. Il doit être manipulé avec précaution. Le patient doit éviter les situations où SoloStar pourrait être endommagé. Si le patient pense que le SoloStar est endommagé, il doit en utiliser un nouveau.
-
- Étape 1 : Vérification de l'insuline :
Vérifier l'étiquette du stylo afin de s'assurer qu'il contient la bonne insuline. Le stylo Apidra SoloStar est bleu avec un bouton d'injection bleu foncé avec un anneau en relief sur le dessus. Après avoir retiré le capuchon du stylo, examiner également l'apparence de l'insuline : elle doit être limpide, incolore, sans particules solides visibles et avoir l'aspect de l'eau.
- Étape 2 : Fixation de l'aiguille :
N'utiliser que des aiguilles approuvées pour être utilisées avec SoloStar.
Utiliser toujours une aiguille neuve stérile avant chaque injection. Après avoir retiré le capuchon, l'aiguille doit être soigneusement fixée de façon bien droite sur le stylo.
- Étape 3 : Test de sécurité :
Avant chaque injection un test de sécurité doit être effectué.
Une dose de 2 unités doit être sélectionnée. Retirer les capuchons extérieur et intérieur de l'aiguille.
Tout en maintenant le stylo avec l'aiguille pointée vers le haut, tapoter doucement le réservoir à insuline avec le doigt afin que toute éventuelle bulle d'air remonte vers l'aiguille.
Appuyer alors à fond sur le bouton d'injection.
Si l'insuline a été expulsée à l'extrémité de l'aiguille, alors le stylo et l'aiguille fonctionnent correctement.
Si aucune insuline n'apparaît à l'extrémité de l'aiguille, répéter l'étape 3 jusqu'à ce que de l'insuline apparaisse à l'extrémité de l'aiguille.
- Étape 4 : Réglage de la dose :
La sélection de la dose s'effectue par intervalles de 1 unité, d'un minimum de 1 unité à un maximum de 80 unités. Si une dose supérieure à 80 unités est nécessaire, elle devra être administrée en deux ou plus de deux injections.
Après avoir effectué le test de sécurité, le chiffre « 0 » doit apparaître sur la fenêtre d'affichage de la dose. La dose peut alors être sélectionnée.
- Étape 5 : Injection de la dose :
Le patient doit être éduqué sur les techniques d'injection par son professionnel de santé.
L'aiguille doit être introduite dans la peau.
Le bouton d'injection doit être enfoncé à fond. Le bouton d'injection doit ensuite être maintenu enfoncé pendant 10 secondes avant de retirer l'aiguille. Ceci garantit que la dose entière a été injectée.
- Étape 6 : Retrait et élimination de l'aiguille :
Après chaque injection, l'aiguille doit toujours être retirée et éliminée. Cette mesure préviendra tout risque de contamination et/ou d'infection, d'entrée d'air dans le réservoir à insuline et de fuite d'insuline. Les aiguilles ne doivent pas être réutilisées.
Prendre des précautions particulières concernant le retrait et l'élimination de l'aiguille. Les mesures de sécurité recommandées doivent être suivies (par exemple, la technique qui consiste à recouvrir l'aiguille à l'aide de son capuchon) afin de réduire le risque de blessure accidentelle avec l'aiguille et la transmission de maladies infectieuses.
Le capuchon du stylo doit être replacé sur le stylo.
- Étape 1 : Vérification de l'insuline :
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| AMM | EU/1/04/285/001 ; CIP 3400936518094 (RCP rév 24.01.2011) flacon. |
| EU/1/04/285/008 ; CIP 3400936569423 (RCP rév 24.01.2011) cartouche. | |
| EU/1/04/285/032 ; CIP 3400937722001 (RCP rév 24.01.2011) stylo prérempli SoloStar. |
| Prix : | 21.65 euros (1 flacon de 10 ml). |
| 39.74 euros (5 cartouches). | |
| 43.18 euros (5 stylos préremplis SoloStar). | |
| Remb Séc soc à 65 %. Collect. | |
sanofi-aventis France
1-13, bd Romain-Rolland. 75014 Paris
Info médic et pharmacovigilance :
Tél (n° Vert) : 08 00 39 40 00
Fax : 01 57 62 06 62
Service stylos injecteurs d'insulines :
Tél (n° Vert) : 08 00 10 52 53
