SPIRIVA®
tiotropium bromure
FORMES et PRÉSENTATIONS |
Modèle hospitalier : Boîte de 10, sous plaquette thermoformée prédécoupée + dispositif Handihaler.
COMPOSITION |
| p gélule | |
| Tiotropium | 18 µg |
| (sous forme de bromure de tiotropium [DCI] monohydraté : 22,5 µg/gélule) | |
La dose délivrée à l'embout buccal du dispositif Handihaler est de 10 µg de tiotropium.
Teneur en lactose monohydraté : 5,5 mg/gélule.
INDICATIONS |
POSOLOGIE ET MODE D'ADMINISTRATION |
La posologie recommandée de bromure de tiotropium est l'inhalation du contenu d'une gélule une fois par jour à heure fixe dans la journée (le contenu de la gélule est à inhaler à l'aide du dispositif Handihaler).
Coût du traitement journalier : 1,36 euro(s).La poudre de bromure de tiotropium contenue dans la gélule devra être inhalée uniquement à l'aide du dispositif Handihaler.
Ne pas dépasser la dose recommandée.
- Populations particulières :
-
- Sujet âgé : Le bromure de tiotropium peut être utilisé chez les sujets âgés à la dose recommandée.
- Insuffisance rénale : Chez les patients atteints d'insuffisance rénale, le bromure de tiotropium peut être utilisé à la dose recommandée. En cas d'insuffisance rénale modérée à sévère (clairance de la créatinine <= 50 ml/min), cf Mises en garde/Précautions d'emploi et Pharmacocinétique.
- Insuffisance hépatique : Le bromure de tiotropium peut être utilisé à la dose recommandée chez les patients atteints d'insuffisance hépatique (cf Pharmacocinétique).
- Utilisation pédiatrique : La tolérance et l'efficacité du bromure de tiotropium sous forme de poudre pour inhalation en gélule n'ont pas été établies en pédiatrie. Par conséquent, son utilisation est déconseillée chez les patients de moins de 18 ans.
- Sujet âgé : Le bromure de tiotropium peut être utilisé chez les sujets âgés à la dose recommandée.
Mode d'administration :
Ne pas avaler les gélules.
- Instructions pour la manipulation et l'utilisation :
- Les instructions suivantes permettent d'expliciter au patient comment inhaler le contenu d'une gélule de Spiriva à l'aide du dispositif Handihaler.
- Suivre toujours scrupuleusement les instructions du médecin pour utiliser Spiriva. Le dispositif Handihaler est exclusivement conçu pour Spiriva et ne doit pas être utilisé pour prendre un autre médicament. Ce dispositif peut être utilisé pendant un an au maximum pour prendre Spiriva.
- Le dispositif Handihaler :
-
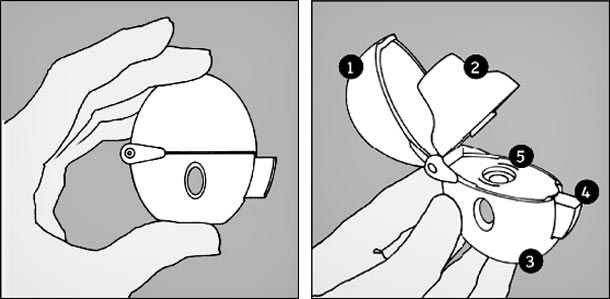
1 : capuchon antipoussière. 2 : embout buccal. 3 : base. 4 : bouton-perforateur. 5 : chambre centrale.
-
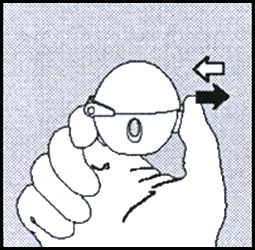
1. Pour libérer le capuchon antipoussière, appuyer complètement sur le bouton perforateur puis le relâcher.
-
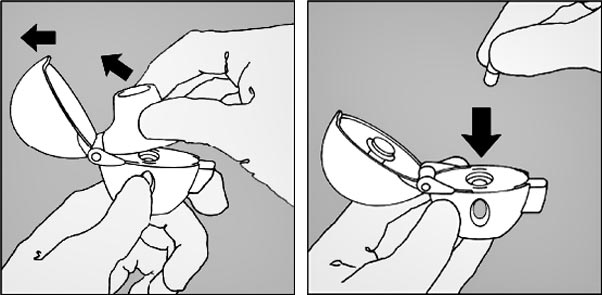
2. Relever complètement le capuchon antipoussière en le tirant vers le haut puis ouvrir l'embout buccal en le tirant vers le haut.
3. Prendre une gélule de Spiriva du blister (juste avant l'utilisation) et la placer dans la chambre centrale (5), conformément à l'illustration. La façon dont la gélule est placée dans la chambre centrale importe peu.
-
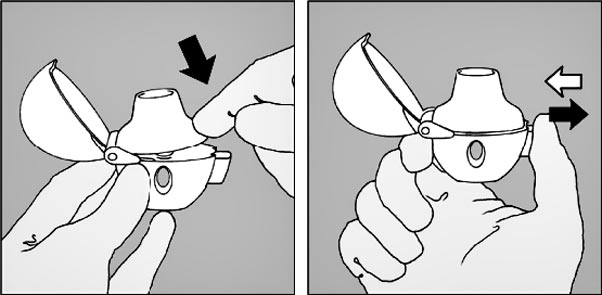
4. Refermer l'embout buccal jusqu'à entendre un clic et laisser le capuchon antipoussière ouvert.
5. Tenir le dispositif Handihaler vertical, l'embout buccal dirigé vers le haut et enfoncer complètement le bouton-perforateur (vert) d'une seule pression, puis relâcher. Ceci perfore la gélule et libère le médicament qui sera inhalé lors de l'inspiration.
-
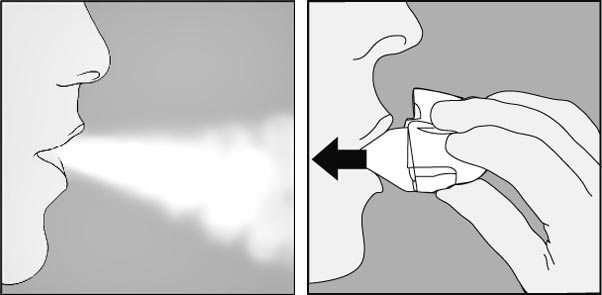
6. Expirer à fond. Important : ne jamais expirer dans l'embout buccal.
7. Porter le Handihaler à la bouche et refermer fermement les lèvres autour de l'embout buccal. Maintenir la tête droite et inspirer lentement et profondément, à un rythme toutefois suffisant pour entendre ou sentir la gélule vibrer. Inspirer jusqu'à remplir complètement les poumons, puis retenir sa respiration aussi longtemps que possible et ôter le dispositif Handihaler de la bouche. Reprendre une respiration normale et répéter une fois les étapes 6 et 7, ce qui videra totalement la gélule de son contenu.
-
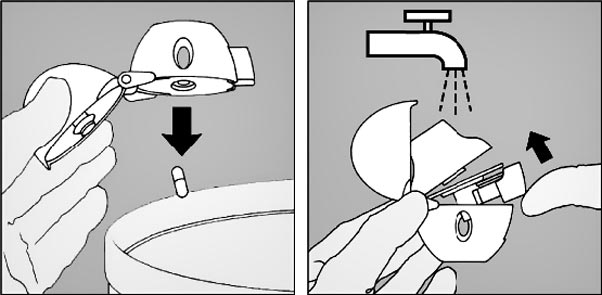
8. Ouvrir à nouveau l'embout buccal. Faire tomber la gélule et la jeter. Refermer l'embout buccal et le capuchon antipoussière pour conserver le Handihaler.
Nettoyage du Handihaler :
Nettoyer le Handihaler une fois par mois. Ouvrir le capuchon antipoussière et l'embout buccal, puis ouvrir la base en soulevant le bouton perforateur. Rincer complètement l'inhalateur à l'eau chaude pour enlever toute poudre restante. Sécher soigneusement le Handihaler en absorbant l'excès d'eau sur une serviette en papier puis laisser sécher à l'air, en laissant l'embout buccal, le capuchon antipoussière et la base ouverts. Cette opération de séchage à l'air prend 24 heures. Nettoyer donc le Handihaler juste après l'avoir utilisé et il sera prêt pour la dose suivante. Si nécessaire, nettoyer la surface externe de l'embout buccal avec un chiffon humide mais non mouillé.
-
Manipulation du blister :
- Séparer le blister prédécoupé en détachant selon la perforation.
- Relever la feuille d'aluminium (juste avant l'utilisation) jusqu'à ce qu'une seule gélule devienne complètement visible.
Si une seconde gélule est exposée à l'air par inadvertance, celle-ci doit être jetée.
- Sortir la gélule.
- Séparer le blister prédécoupé en détachant selon la perforation.
- Les gélules de Spiriva ne contiennent qu'une petite quantité de poudre et ne sont donc que partiellement remplies.
CONTRE-INDICATIONS |
MISES EN GARDE et PRÉCAUTIONS D'EMPLOI |
- Le bromure de tiotropium est un traitement bronchodilatateur continu de longue durée d'action en une prise par jour et ne doit pas être utilisé comme un médicament de secours de première intention pour le traitement des épisodes aigus de bronchospasme.
- Des réactions d'hypersensibilité immédiate peuvent apparaître après l'administration de bromure de tiotropium sous forme de poudre pour inhalation.
- Compte tenu de son activité anticholinergique, le bromure de tiotropium doit être utilisé avec prudence en cas de glaucome à angle fermé, d'hypertrophie de la prostate ou de rétrécissement du col de la vessie (cf Effets indésirables).
- D'une façon générale, l'administration de médicaments par voie inhalée est susceptible de déclencher un bronchospasme.
- Les concentrations plasmatiques de bromure de tiotropium augmentent en cas d'altération de la fonction rénale ; par conséquent chez les patients atteints d'insuffisance rénale modérée à sévère (clairance de la créatinine <= 50 ml/min), le produit ne sera utilisé que si le bénéfice attendu dépasse le risque potentiel. A ce jour, il n'y a pas d'expérience à long terme chez les patients souffrant d'insuffisance rénale sévère (cf Pharmacocinétique).
- Il conviendra d'avertir les patients du risque de déclenchement ou d'aggravation d'un glaucome à angle fermé, de douleur ou gêne oculaire, de vision floue transitoire avec halo visuel coloré associé à une rougeur et un oedème cornéoconjonctival, en cas de projection intraoculaire de la poudre. Si une combinaison quelconque de ces symptômes oculaires apparaît, les patients doivent interrompre immédiatement l'utilisation du bromure de tiotropium et consulter immédiatement un médecin.
- La sécheresse buccale observée avec les traitements anticholinergiques en général peut à long terme favoriser la survenue de caries dentaires.
- La posologie du bromure de tiotropium ne doit pas dépasser une prise par jour (cf Surdosage).
- Spiriva gélule contient du lactose monohydraté (cf Composition).
INTERACTIONS |
La coadministration de bromure de tiotropium avec d'autres médicaments anticholinergiques n'a pas été étudiée et n'est, par conséquent, pas recommandée.
GROSSESSE et ALLAITEMENT |
Les études chez l'animal ont montré une toxicité sur la reproduction associée à une toxicité maternelle (cf Sécurité préclinique). Le risque potentiel dans l'espèce humaine est inconnu. Spiriva ne doit par conséquent être administré au cours de la grossesse que si son indication est clairement justifiée.
Il n'a pas été établi si le bromure de tiotropium était excrété dans le lait maternel. Malgré des études effectuées chez les rongeurs ayant démontré que le bromure de tiotropium était excrété dans le lait maternel uniquement en petites quantités, l'utilisation de Spiriva n'est pas recommandée au cours de l'allaitement. Le bromure de tiotropium est un composé à longue durée d'action. La décision de poursuivre ou d'interrompre l'allaitement ou le traitement par Spiriva doit être prise en tenant compte du bénéfice de l'allaitement chez l'enfant et du bénéfice du traitement par Spiriva chez la femme.
CONDUITE et UTILISATION DE MACHINES |
EFFETS INDÉSIRABLES |
- Description générale :
- Un grand nombre des événements indésirables mentionnés peuvent être attribués à l'action anticholinergique de Spiriva.
- Tableau des effets indésirables :
- Les fréquences attribuées aux effets indésirables dont la liste figure ci-dessous sont basées sur les taux d'incidence bruts des réactions médicamenteuses indésirables (c'est-à-dire des événements attribués au tiotropium) observées dans le groupe du tiotropium (9149 patients) et survenues au cours du regroupement de 26 études cliniques contrôlées versus placebo, pendant des périodes de traitement comprises entre 4 semaines et 4 ans.
- La fréquence est définie selon les modalités conventionnelles : très fréquent (>= 1/10) ; fréquent (>= 1/100 à < 1/10) ; peu fréquent (>= 1/1 000 à < 1/100) ; rare (>= 1/10 000 à < 1/1 000) ; très rare (< 1/10 000) ; non déterminée (fréquence ne pouvant être estimée sur la base des données cliniques disponibles).
-
Terme usuel MedDRA Fréquence Troubles du métabolisme et de la nutrition : - Déshydratation
Non déterminé* Affections du système nerveux : - Étourdissements
Peu fréquent - Céphalées
Peu fréquent - Dysgueusie
Peu fréquent - Insomnie
Rare Affections oculaires : - Vision trouble
Peu fréquent - Glaucome
Rare - Augmentation de la pression intraoculaire
Rare Troubles cardiaques : - Fibrillation auriculaire
Peu fréquent - Tachycardie supraventriculaire
Rare - Tachycardie
Rare - Palpitations
Rare Affections respiratoires, thoraciques et médiastinales : - Pharyngite
Peu fréquent - Dysphonie
Peu fréquent - Toux
Peu fréquent - Bronchospasme
Rare - Épistaxis
Rare - Laryngite
Rare - Sinusite
Rare Affections gastro-intestinales : - Sécheresse buccale
Fréquent - Stomatite
Peu fréquent - Reflux gastro-oesophagien
Peu fréquent - Constipation
Peu fréquent - Nausées
Peu fréquent - Obstruction intestinale, y compris iléus paralytique
Rare - Gingivite
Rare - Glossite
Rare - Candidose oropharyngée
Rare - Dysphagie
Rare - Caries dentaires
Non déterminé* Affections de la peau et du tissu sous-cutané, affections du système immunitaire : - Éruption cutanée
Peu fréquent - Urticaire
Rare - Prurit
Rare - Hypersensibilité (y compris réactions d'hypersensibilité immédiate)
Rare - OEdème de Quincke
Non déterminé* - Infection cutanée, ulcération cutanée
Non déterminé* - Peau sèche
Non déterminé* Affections musculosquelettiques et systémiques : - Articulations enflées
Non déterminé* Affections du rein et des voies urinaires : - Dysurie
Peu fréquent - Rétention urinaire
Peu fréquent - Infection du tractus urinaire
Rare -
*
aucun événement attribué au tiotropium chez 9149 patients traités par le tiotropium ; cependant, ces événements sont considérés comme des réactions médicamenteuses indésirables associées au tiotropium.
- Données caractérisant les effets indésirables individuels graves et/ou fréquents :
- Dans les essais cliniques contrôlés, les effets indésirables le plus fréquemment observés ont été des effets indésirables de type anticholinergique telle que la sécheresse buccale survenue chez environ 4 % des patients. Dans 26 essais cliniques, la sécheresse buccale a été à l'origine de 18 arrêts de traitement parmi les 9149 patients traités par le tiotropium (soit 0,2 % des patients traités).
- Les effets indésirables graves attribués aux effets anticholinergiques incluent : glaucome, constipation et occlusion intestinale, y compris iléus paralytique, ainsi que rétention urinaire.
- Information additionnelle sur les populations particulières :
- L'incidence des effets anticholinergiques peut augmenter avec l'âge.
SURDOSAGE |
Cependant, l'inhalation d'une dose allant jusqu'à 340 µg de bromure de tiotropium n'a été suivie d'aucun effet indésirable de type anticholinergique systémique chez des volontaires sains. En outre, aucun effet indésirable significatif, hormis la sécheresse buccale, n'a été observé après 7 jours d'administration de doses de bromure de tiotropium allant jusqu'à 170 µg chez des volontaires sains. Aucun effet indésirable significatif n'a par ailleurs été observé lors d'une étude de 4 semaines réalisée chez des patients atteints de BPCO, recevant des doses journalières maximales de 43 µg de bromure de tiotropium.
En cas d'ingestion accidentelle de gélules de bromure de tiotropium, l'intoxication aiguë est peu probable compte tenu de la faible biodisponibilité orale.
PHARMACODYNAMIE |
Classe pharmacothérapeutique : anticholinergiques (code ATC : R03BB04).
Le bromure de tiotropium est un antagoniste spécifique des récepteurs muscariniques de longue durée d'action, souvent désigné en pratique clinique sous le terme « anticholinergique ». En se fixant aux récepteurs muscariniques des muscles lisses des bronches, le bromure de tiotropium inhibe les effets cholinergiques (bronchoconstriction) de l'acétylcholine, libérée à partir des terminaisons nerveuses parasympathiques. Il possède une affinité similaire pour les sous-types de récepteurs muscariniques M1 à M5. Dans les voies aériennes, le bromure de tiotropium inhibe de façon réversible et compétitive les récepteurs M3, ce qui se traduit par une relaxation du muscle lisse bronchique. L'effet est dose-dépendant et persiste plus de 24 heures. La longue durée d'action est probablement due à la dissociation très lente des récepteurs M3, la demi-vie de dissociation étant significativement plus longue que celle observée avec l'ipratropium.
Anticholinergique N-quaternaire, le bromure de tiotropium exerce un effet sélectif direct au niveau des bronches lorsqu'il est administré par inhalation, et offre ainsi une marge thérapeutique acceptable avant l'apparition d'effets anticholinergiques systémiques. La bronchodilatation est principalement due à un effet local (sur les voies aériennes) et non pas à un effet systémique.
Le tiotropium se dissocie plus rapidement des récepteurs M2 que des récepteurs M3, comme le suggèrent les études in vitro, marquant une sélectivité plus importante (exprimée de façon cinétique) pour les récepteurs de type M3 par rapport à M2.
La fixation importante et prolongée aux récepteurs explique la bronchodilatation cliniquement significative et de longue durée chez les patients atteints de BPCO.
Électrophysiologie : lors d'une étude spécifique de l'intervalle QT conduite chez 53 volontaires sains, Spiriva administré à la dose de 18 µg et 54 µg (soit trois fois la dose thérapeutique) pendant 12 jours n'a pas augmenté de façon significative l'intervalle QT sur l'électrocardiographe.
Le programme de développement clinique comprend quatre études d'un an et deux études de 6 mois, toutes randomisées et en double aveugle, portant sur un total de 2663 patients, dont 1308 ont reçu le bromure de tiotropium. Parmi les études menées sur un an, deux étaient contrôlées contre placebo et deux contre un comparateur actif (ipratropium), alors que les deux études de 6 mois étaient contrôlées contre placebo et salmétérol. Ces études ont inclus des mesures de la fonction pulmonaire et les critères cliniques tels que dyspnée, exacerbations et qualité de vie.
Dans ces études, l'administration de bromure de tiotropium en dose unique journalière a permis d'obtenir une augmentation significative de la fonction pulmonaire (volume expiré maximum lors de la première seconde [VEMS] et capacité vitale forcée [CVF]) dans les 30 minutes suivant la première dose et se maintenant pendant 24 heures. L'état d'équilibre pharmacodynamique a été atteint en une semaine, l'effet bronchodilatateur maximal étant observé dès le troisième jour. Les mesures effectuées quotidiennement par le patient ont montré que le bromure de tiotropium a significativement amélioré le DEP (débit expiratoire de pointe) du matin et du soir. L'activité bronchodilatatrice du bromure de tiotropium s'est maintenue au cours de l'année pendant laquelle le produit était administré, sans épuisement de l'effet.
Une étude clinique randomisée, contrôlée contre placebo, réalisée chez 105 patients atteints de BPCO, a révélé pendant la totalité de l'intervalle de 24 heures entre deux prises un effet bronchodilatateur par rapport au placebo se maintenant, quel que soit le moment de l'administration, le matin ou le soir.
Les études à long terme (6 mois et 1 an) ont démontré l'effet suivant sur la santé :
Le bromure de tiotropium a significativement amélioré la dyspnée (mesurée d'après l'indice de dyspnée transitionnel de Mahler), cette amélioration se maintenant sur toute la période du traitement.
L'impact de l'amélioration de la dyspnée sur la tolérance à l'exercice a été étudié dans deux essais cliniques randomisés, en double aveugle, contrôlés versus placebo chez 433 patients atteints de bronchopneumopathie chronique obstructive (BPCO) modérée à sévère. Lors de ces essais, un traitement de 6 semaines avec Spiriva a significativement amélioré le temps d'endurance au cours d'un exercice standardisé sur cyclo-ergomètre à 75 % de la puissance maximale, de 19,7 % (essai A : 640 secondes avec Spiriva versus 535 secondes avec le placebo, en comparaison à un temps à l'inclusion avant traitement de 492 secondes) et de 28,3 % (essai B : 741 secondes avec Spiriva versus 577 secondes pour le placebo, en comparaison à un temps à l'inclusion avant traitement de 537 secondes).
Dans un essai clinique randomisé, en double aveugle, contrôlé versus placebo chez 1829 patients atteints de bronchopneumopathie chronique obstructive (BPCO) modérée à sévère, le bromure de tiotropium a réduit de façon statistiquement significative la proportion de patients présentant des exacerbations de BPCO (de 32,2 % à 27,8 %) et réduit de façon statistiquement significative le nombre d'exacerbations de 19 % (de 1,05 à 0,85 exacerbation par patient par an). De plus, 7,0 % des patients du groupe bromure de tiotropium contre 9,5 % des patients du groupe placebo ont été hospitalisés pour une exacerbation de BPCO (p = 0,056). Le nombre d'hospitalisations dû à la BPCO a été réduit de 30 % (de 0,25 à 0,18 par patient par an).
Lors d'un essai clinique randomisé, en double aveugle et contre placebo de 9 mois chez 492 patients, Spiriva a amélioré la qualité de vie telle que déterminée par le score total du questionnaire respiratoire du Saint George's Hospital (SGRQ). La proportion des patients traités par Spiriva chez lesquels le score total de ce questionnaire s'est cliniquement amélioré de plus de 4 unités était de 10,9 % plus élevée que dans le groupe placebo (59,1 % dans le groupe Spiriva contre 48,2 % dans le groupe placebo [p = 0,029]). La différence moyenne entre les groupes était de 4,19 unités (p = 0,001 ; intervalle de confiance : 1,69 - 6,68). Les domaines du SGRQ « activité » et « impact sur la vie quotidienne » n'étaient pas significativement améliorés, alors que l'amélioration du score total du SGRQ résultait d'une amélioration marquée du domaine relatif aux « symptômes ».
Dans un essai clinique de 4 ans, randomisé, en double aveugle, contrôlé versus placebo chez 5993 patients randomisés (3006 dans le groupe placebo et 2987 dans le groupe Spiriva), l'amélioration du VEMS par rapport au placebo est restée constante tout au long de la période d'étude de 4 ans.
Une plus grande proportion de patients ont pris au moins 45 mois de traitement dans le groupe Spiriva par rapport au groupe placebo (63,8 % vs 55,4 %, p < 0.001). Le taux annuel de déclin du VEMS comparé au placebo a été similaire entre Spiriva et le placebo. Pendant la période de traitement, il a été retrouvé une réduction du risque de mortalité de l'ordre de 16 %. L'incidence de la mortalité a été de 4,79 pour 100 patients-année dans le groupe placebo vs 4,10 pour 100 patients-année dans le groupe tiotropium (hazard ratio [tiotropium/placebo] = 0,84, intervalle de confiance à 95 % : 0,73-0,97). Avec le traitement par tiotropium, la survenue de cas d'insuffisances respiratoires (déclarés en tant qu'événements indésirables) a été plus faible par rapport au groupe placebo de 19 % (2,09 vs 1,68 cas pour 100 patients-année, risque relatif [tiotropium/placebo] = 0,81, intervalle de confiance à 95 % : 0,65-0,999).
PHARMACOCINÉTIQUE |
- Généralités :
- Le bromure de tiotropium est un ammonium quaternaire non chiral, peu soluble dans l'eau. Il est administré par voie inhalée sous forme de poudre sèche. Après inhalation, la majorité de la dose délivrée se dépose au niveau du tractus digestif et, dans une plus faible mesure, au niveau de l'organe cible, le poumon. De nombreux résultats pharmacocinétiques décrits dans les paragraphes suivants ont été obtenus avec des doses plus élevées que celles recommandées en clinique.
- Caractéristiques pharmacocinétiques générales du principe actif après administration de la spécialité :
-
- Absorption :
Après inhalation de poudre sèche chez de jeunes volontaires sains, la biodisponibilité absolue est de 19,5 %, ce qui suggère que la fraction atteignant le poumon présente une biodisponibilité élevée. En raison de la structure chimique du produit (ammonium quaternaire) et compte tenu des résultats des expérimentations in vitro, l'absorption digestive attendue du bromure de tiotropium (10-15 %) est faible. La biodisponibilité absolue des solutions orales de bromure de tiotropium est de 2 à 3 %. Les concentrations plasmatiques maximales de bromure de tiotropium ont été atteintes cinq minutes après l'inhalation. La prise d'aliments ne semble pas influencer l'absorption de cet ammonium quaternaire.
- Distribution :
La liaison du bromure de tiotropium aux protéines plasmatiques est de 72 % et son volume de distribution est de 32 l/kg. Chez les patients présentant une BPCO, les concentrations plasmatiques maximales de bromure de tiotropium atteintes à l'équilibre sont de l'ordre de 17-19 pg/ml 5 minutes après l'inhalation d'une dose de 18 µg de poudre, puis les concentrations plasmatiques diminuent rapidement selon un schéma à plusieurs compartiments. Les concentrations plasmatiques minimales atteintes à l'équilibre sont de 3-4 pg/ml. On ne connaît pas les concentrations pulmonaires locales, mais le mode d'administration laisse penser qu'elles sont beaucoup plus élevées. Les études chez le rat ont montré que le bromure de tiotropium ne traverse pas la barrière hématoencéphalique de façon significative.
- Métabolisme :
Le métabolisme du bromure de tiotropium est faible. Chez de jeunes volontaires sains, l'excrétion urinaire de la substance non métabolisée atteint 74 % de la dose après une administration intraveineuse. L'ester du bromure de tiotropium est clivé, indépendamment d'un mécanisme enzymatique, en un dérivé alcool (N-méthylscopine) et un dérivé acide (acide dithiénylglycolique), inactifs sur les récepteurs muscariniques. Les études réalisées in vitro sur des microsomes hépatiques et des hépatocytes d'origine humaine montrent qu'une petite partie supplémentaire (< 20 % de la dose administrée par voie intraveineuse) est métabolisée par une réaction d'oxydation dépendante du cytochrome P450 (CYP) puis par conjugaison avec le glutathion, donnant naissance à une série de métabolites de phase II.
Les études in vitro effectuées sur des microsomes hépatiques suggèrent une inhibition du métabolisme par les inhibiteurs du CYP 2D6 (et 3A4), la quinidine, le kétoconazole et le gestodène. Les isoenzymes CYP 2D6 et 3A4 sont donc impliquées pour une part dans le métabolisme. Il n'a pas été mis en évidence d'effet inhibiteur, même avec des concentrations élevées, sur les isoenzymes CYP 1A1, 1A2, 2B6, 2C9, 2C19, 2D6, 2E1 ou 3A sur microsomes hépatiques humains.
- Élimination :
La demi-vie d'élimination terminale du bromure de tiotropium est comprise entre 5 et 6 jours après inhalation. La clairance totale a été de 880 ml/min après une dose intraveineuse chez de jeunes volontaires sains, avec une variabilité interindividuelle de 22 %. Le bromure de tiotropium administré par voie intraveineuse est essentiellement éliminé par voie urinaire sous forme inchangée (74 %). Après inhalation de la poudre, 14 % de la dose est excrétée par voie urinaire, le reste étant éliminé sous forme inchangée dans les fèces. La clairance rénale du bromure de tiotropium est plus élevée que la clairance de la créatinine, reflétant une sécrétion urinaire. Après inhalation chronique quotidienne en une prise par jour chez des patients atteints de BPCO, l'état d'équilibre pharmacocinétique est atteint en 2-3 semaines sans accumulation.
- Linéarité/non-linéarité :
Tant après administration par voie intraveineuse que par inhalation sous forme de poudre, la pharmacocinétique du bromure de tiotropium est linéaire aux doses thérapeutiques.
- Absorption :
- Caractéristiques pharmacocinétiques dans des populations particulières :
-
- Sujet âgé :
Comme pour les médicaments excrétés majoritairement par voie rénale, la clairance rénale du bromure de tiotropium diminue avec l'âge (326 ml/min chez des sujets atteints de BPCO de moins de 58 ans contre 163 ml/min chez des patients atteints de BPCO de plus de 70 ans), ce qui peut s'expliquer par l'altération de la fonction rénale. Après inhalation, l'excrétion urinaire de bromure de tiotropium diminue de 14 % (jeunes volontaires sains) à environ 7 % chez des patients atteints de BPCO. Toutefois, les concentrations plasmatiques ne varient pas significativement en fonction de l'âge chez des patients atteints de BPCO, si on compare les variations inter- et intra-individuelles (augmentation de 43 % de l'AUC0-4 h après inhalation sous forme de poudre).
- Insuffisance rénale :
Comme avec tous les autres médicaments principalement excrétés par voie rénale, l'insuffisance rénale s'accompagne d'une augmentation des concentrations plasmatiques du médicament et d'une diminution de sa clairance rénale, tant après perfusion intraveineuse qu'après inhalation sous forme de poudre. L'existence d'une insuffisance rénale légère (ClCr 50-80 ml/min), souvent observée chez le sujet âgé, n'augmente que légèrement les concentrations plasmatiques de bromure de tiotropium (augmentation de 39 % de l'AUC0-4 h après perfusion intraveineuse). Chez les patients atteints de BPCO et présentant une insuffisance rénale modérée à sévère (ClCr < 50 ml/min), les concentrations plasmatiques de bromure de tiotropium ont été doublées (augmentation de 82 % de l'AUC0-4 h) après l'administration intraveineuse du médicament. Ce phénomène a été confirmé par la mesure des concentrations plasmatiques après inhalation sous forme de poudre.
- Insuffisance hépatique :
Il n'est pas attendu de modification significative de la pharmacocinétique du bromure de tiotropium en cas d'insuffisance hépatique, dans la mesure où le produit est essentiellement éliminé par voie urinaire (74 % chez le jeune volontaire sain) et métabolisé par simple clivage non enzymatique des liaisons esters, en produits pharmacologiquement inactifs.
- Pédiatrie :
Cf Posologie/Mode d'administration.
- Sujet âgé :
- Relation(s) entre les paramètres pharmacocinétiques et la pharmacodynamie :
- Il n'y a pas de relation directe entre les paramètres pharmacocinétiques et la pharmacodynamie du produit.
SÉCURITE PRÉCLINIQUE |
De nombreux effets observés dans les études conventionnelles de pharmacologie de sécurité, de toxicité en administration répétée et de toxicité des fonctions de reproduction peuvent s'expliquer par les propriétés anticholinergiques du bromure de tiotropium.
Chez l'animal, ont ainsi été observées une diminution de la consommation de nourriture, une réduction de la prise de poids, une sécheresse buccale et nasale, une réduction de la sécrétion de larmes et de salive, une mydriase et une augmentation du rythme cardiaque. D'autres effets notables ont été observés lors des études de toxicité en administration répétée : légère irritation du tractus respiratoire chez le rat et la souris, se manifestant par une rhinite et des altérations de l'épithélium de la cavité nasale et du larynx, et prostatite avec dépôts de substances de type protéinique et lithiases vésicales chez le rat.
Des effets délétères sur la gestation, le développement embryofoetal, la parturition ou le développement postnatal n'ont été observés qu'à des doses toxiques pour les mères.
Le bromure de tiotropium n'a pas induit d'effets tératogènes chez le rat et le lapin. Les effets sur l'appareil respiratoire (irritation) et urogénital (prostatite), ainsi que des effets délétères sur les fonctions de reproduction ont été observés après administration locale ou systémique de doses cinq fois supérieures à la dose thérapeutique. Les études de génotoxicité et de carcinogenèse n'ont pas révélé de risque particulier pour l'homme.
CONDITIONS DE CONSERVATION |
A conserver à une température ne dépassant pas 25 °C.
Ne pas congeler.
Après la première ouverture de la plaquette thermoformée : 9 jours.
Jeter le dispositif Handihaler 12 mois après la première utilisation.
MODALITÉS MANIPULATION/ÉLIMINATION |
Cf Posologie/Mode d'administration.
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| AMM | 3400936869202 (2005 rév 05.11.2009) 30 gél + disp unidose p inhal Handihaler. |
| 3400957076269 (2007 rév 05.11.2009) 10 gél + disp unidose p inhal Handihaler. |
| Prix : | 40.76 euros (30 gélules + Handihaler). |
| Remb Séc soc à 65 %. Collect. | |
| Modèle hospitalier : Collect. | |
BOEHRINGER INGELHEIM FRANCE
14, rue Jean-Antoine-de-Baïf. 75644 Paris cdx 13
Info médic et pharmacovigilance :
12, rue André-Huet. 51100 Reims
Info médic : Tél : 03 26 50 45 33
Pharmacovigilance : Tél : 03 26 50 47 70
