INSULINES SANOFI-AVENTIS LANTUS®
insuline glargine
FORMES et PRÉSENTATIONS |
Lantus 100 unités/ml en flacon :
Solution injectable SC (limpide, incolore) : Flacon de 10 ml, boîte unitaire. Lantus 100 unités/ml en cartouche :
Solution injectable SC (limpide, incolore) : Cartouches de 3 ml, boîte de 5.
Lantus 100 unités/ml en stylo prérempli OptiSet® :
Solution injectable SC (limpide, incolore) : Cartouches de 3 ml, scellées dans un stylo injecteur prérempli jetable (aiguilles non fournies), boîte de 5.
Lantus 100 unités/ml en stylo prérempli SoloStar® :
Solution injectable SC (limpide, incolore) : Cartouches de 3 ml, scellées dans un stylo injecteur prérempli jetable (aiguilles non fournies), boîte de 5.
COMPOSITION |
| Lantus en flacon : | p flacon |
| Insuline glargine (DCI) | 1000 unités |
| (équivalant à 3,64 mg/ml de substance active) | |
| Lantus en cartouche ou en stylo : | p cartouche/p stylo | |
| Insuline glargine (DCI) | 300 unités | |
| (équivalant à 3,64 mg/ml de substance active) | ||
L'insuline glargine est produite par la technique de l'ADN recombinant sur Escherichia coli.
INDICATIONS |
POSOLOGIE ET MODE D'ADMINISTRATION |
Lantus contient de l'insuline glargine, un analogue de l'insuline, et a une durée d'action prolongée. Lantus doit être administré une fois par jour à n'importe quel moment de la journée mais au même moment chaque jour. OptiSet délivre une dose unitaire allant de 2 unités jusqu'à un maximum de 40 unités.
Le schéma posologique de Lantus (posologie et moment d'administration) doit être ajusté individuellement. Chez les patients atteints de diabète de type 2, Lantus peut également être associé à des antidiabétiques oraux. L'activité de ce médicament est exprimée en unités. Ces unités sont spécifiques à Lantus et ne correspondent ni aux UI, ni aux unités utilisées pour les autres analogues de l'insuline. Cf Pharmacodynamie.
- Sujet âgé (>= 65 ans) :
- Chez les patients âgés, une altération progressive de la fonction rénale peut provoquer une diminution régulière des besoins en insuline.
- Insuffisance rénale :
- Chez les patients insuffisants rénaux, les besoins en insuline peuvent être diminués en raison d'une réduction du métabolisme de l'insuline.
- Insuffisance hépatique :
- Chez les patients insuffisants hépatiques, les besoins en insuline peuvent être diminués en raison d'une réduction de la capacité de la néoglucogenèse et d'une réduction du métabolisme de l'insuline.
- Population pédiatrique :
- La sécurité et l'efficacité de Lantus ont été établies chez l'adolescent et l'enfant à partir de 6 ans. Chez l'enfant, l'efficacité et la sécurité n'ont été démontrées que lorsque Lantus est administré le soir. L'expérience sur l'efficacité et la sécurité de Lantus chez les enfants de moins de 6 ans étant limitée, Lantus ne pourra être utilisé chez ces patients que sous contrôle médical attentif.
- Transition d'autres insulines à Lantus :
- Quand on remplace une insuline d'action intermédiaire ou d'action prolongée par Lantus, il peut être nécessaire de modifier la dose d'insuline et/ou d'ajuster la posologie du traitement antidiabétique concomitant (doses et horaires d'administration des insulines rapides ou des analogues rapides de l'insuline ou posologie des antidiabétiques oraux associés).
- Afin de réduire le risque de survenue d'une hypoglycémie nocturne ou de début de journée, les patients qui remplacent leur schéma d'insuline basale de 2 injections journalières d'insuline NPH par une injection quotidienne de Lantus doivent réduire leur dose quotidienne d'insuline basale de 20 à 30 % durant les premières semaines de traitement. Durant les premières semaines, cette réduction doit, au moins en partie, être compensée par une augmentation de l'insuline couvrant les repas ; après cette période, le traitement devra être ajusté individuellement.
- Comme avec d'autres analogues de l'insuline, les patients nécessitant de fortes doses d'insuline en raison de la présence d'anticorps anti-insuline humaine peuvent constater une amélioration de leur réponse à l'insuline avec Lantus.
- Il est recommandé d'assurer une surveillance métabolique étroite pendant la période de transition et les premières semaines qui suivent.
- Quand l'équilibre métabolique s'améliore, augmentant la sensibilité à l'insuline, il peut être nécessaire d'effectuer un ajustement posologique supplémentaire. Un ajustement posologique peut également s'avérer nécessaire par exemple en cas de modification du poids corporel ou du mode de vie du patient, de modification de l'heure d'administration de l'insuline ou dans toute autre circonstance pouvant augmenter la susceptibilité à l'hypo ou à l'hyperglycémie (cf Mises en garde et Précautions d'emploi).
Mode d'administration :
Lantus est administré par voie sous-cutanée.
Lantus ne doit pas être administré par voie intraveineuse. L'effet prolongé de Lantus dépend de l'injection dans le tissu sous-cutané. L'administration intraveineuse de la dose sous-cutanée usuelle risquerait de provoquer une hypoglycémie sévère.
On n'a pas observé de différences cliniques notables, sur le plan des taux sériques d'insuline et de glucose, suivant que Lantus est administré dans l'abdomen, la région deltoïde ou la cuisse. Il faut néanmoins effectuer une rotation des sites d'injection dans une même zone d'injection, d'une injection à l'autre.
Il ne faut ni mélanger Lantus à une autre insuline, ni la diluer. Un mélange ou une dilution risquerait en effet de modifier le profil d'action en fonction du temps et un mélange pourrait provoquer une précipitation.
- Lantus en flacon, en cartouche :
- Pour plus de détails sur la manipulation, se référer à la rubrique Modalités de manipulation et d'élimination.
- Lantus en stylos préremplis OptiSet ou SoloStar :
- Les instructions d'utilisation mentionnées dans la notice doivent être lues avec attention avant toute utilisation (cf Modalités de manipulation et d'élimination).
CONTRE-INDICATIONS |
MISES EN GARDE et PRÉCAUTIONS D'EMPLOI |
Si l'équilibre glycémique n'est pas optimal ou si le patient a tendance à présenter des épisodes hyperglycémiques ou hypoglycémiques, il faut d'abord vérifier le respect par le patient du traitement prescrit, les sites et les techniques d'injection et l'ensemble des autres facteurs susceptibles d'augmenter la tendance à l'hyper- ou à l'hypoglycémie, avant d'envisager l'ajustement de la dose d'insuline.
Tout changement de type d'insuline ou de marque d'insuline doit se faire sous strict contrôle médical. Le changement de concentration, de marque (fabricant), de type d'insuline (régulière, NPH, lente, à durée d'action prolongée, etc.), d'origine (animale, humaine, analogue de l'insuline humaine) et/ou de méthode de fabrication peut nécessiter une adaptation de la dose.
L'administration d'insuline peut provoquer la formation d'anticorps anti-insuline. Dans de rares cas, la présence de ces anticorps anti-insuline peut rendre nécessaire l'ajustement de la dose d'insuline, de manière à corriger une tendance à l'hyper- ou à l'hypoglycémie (cf Effets indésirables).
- Hypoglycémie :
- Le moment de survenue d'une hypoglycémie dépend du profil d'action des insulines utilisées et peut donc changer après modification du schéma thérapeutique. En raison d'un apport soutenu en insuline basale avec Lantus, on peut s'attendre à une diminution des hypoglycémies nocturnes et à une augmentation des hypoglycémies de début de journée.
- Il faut être particulièrement prudent et intensifier la surveillance de la glycémie chez les patients pour lesquels les épisodes hypoglycémiques risqueraient d'avoir des conséquences cliniques particulièrement graves, par exemple en cas de sténose serrée des artères coronaires ou carotidiennes (risque de complications cardiaques ou cérébrales de l'hypoglycémie), de même qu'en cas de rétinopathie proliférante, surtout si celle-ci n'est pas traitée par photocoagulation (risque d'amaurose transitoire après une hypoglycémie).
- Les patients doivent connaître les circonstances dans lesquelles les symptômes précurseurs de l'hypoglycémie sont atténués. Les symptômes précurseurs de l'hypoglycémie peuvent être modifiés, atténués ou absents dans certains groupes à risque, à savoir :
- chez les patients dont l'équilibre glycémique a été nettement amélioré,
- en cas d'installation progressive de l'hypoglycémie,
- chez les patients âgés,
- après passage d'une insuline animale à une insuline humaine,
- en cas de neuropathie végétative,
- chez les patients diabétiques de longue date,
- chez les patients présentant des troubles psychiatriques,
- chez les patients recevant en même temps certains autres médicaments (cf Interactions).
- chez les patients dont l'équilibre glycémique a été nettement amélioré,
- Dans de telles situations, il peut apparaître une hypoglycémie sévère (avec éventuellement perte de conscience) avant que le patient ne se rende compte de l'hypoglycémie.
- L'effet prolongé de l'insuline glargine en sous-cutané peut retarder la récupération d'une hypoglycémie.
- Si le taux d'hémoglobine glycosylée est normal ou abaissé, la possibilité d'épisodes hypoglycémiques récidivants passés inaperçus (surtout nocturnes) doit être évoquée.
- Pour réduire le risque d'hypoglycémie, il est essentiel que le patient respecte les consignes posologiques et diététiques, administre correctement l'insuline et connaisse les symptômes de l'hypoglycémie. Les facteurs qui augmentent la susceptibilité à l'hypoglycémie exigent une surveillance particulièrement stricte et peuvent nécessiter un ajustement posologique. Ces facteurs sont les suivants :
- changement de zone d'injection,
- amélioration de la sensibilité à l'insuline (par exemple après élimination des facteurs de stress),
- exercice physique inhabituel, majoré ou prolongé,
- maladie intercurrente (par exemple vomissements, diarrhée),
- écarts de régime,
- omission de repas,
- prise d'alcool,
- certains troubles non compensés du système endocrinien (par exemple en cas d'hypothyroïdie, d'hypopituitarisme ou d'insuffisance surrénale),
- administration conjointe de certains autres médicaments.
- changement de zone d'injection,
- Maladies intercurrentes :
- Toute maladie intercurrente nécessite un renforcement de la surveillance métabolique. Il est souvent indiqué de rechercher la présence de corps cétoniques dans les urines et souvent nécessaire d'ajuster les doses d'insuline. Les besoins en insuline sont souvent accrus. Les patients diabétiques de type 1 doivent continuer à consommer régulièrement au moins une faible quantité de glucides, même s'ils ne peuvent pas ou presque pas s'alimenter, souffrent de vomissements, etc. Ils ne doivent jamais arrêter complètement l'insuline.
- Erreurs médicamenteuses :
- Des erreurs médicamenteuses ont été rapportées au cours desquelles d'autres insulines, en particulier des insulines d'action rapide, ont été accidentellement administrées à la place de l'insuline glargine. L'étiquette de l'insuline doit toujours être vérifiée avant chaque injection pour éviter les erreurs médicamenteuses entre l'insuline glargine et d'autres insulines.
- Association de Lantus avec la pioglitazone :
- Des cas d'insuffisance cardiaque ont été rapportés lorsque la pioglitazone est associée à l'insuline, en particulier chez les patients ayant des facteurs de risque de développement d'une insuffisance cardiaque. Il faut en tenir compte si un traitement associant Lantus avec la pioglitazone est envisagé. Si l'association est utilisée, il est recommandé de surveiller les signes et symptômes d'insuffisance cardiaque, de prise de poids et d'oedème. La pioglitazone doit être arrêtée devant toute apparition d'une dégradation des symptômes cardiaques.
- Stylos utilisables avec les cartouches Lantus :
- Les cartouches Lantus doivent être utilisées uniquement avec les stylos suivants : OptiPen, ClikStar, Tactipen et Autopen 24 et ne doivent être utilisées avec aucun autre stylo réutilisable puisque la précision de la dose a été établie uniquement avec les stylos précités.
- Manipulation des stylos préremplis Lantus OptiSet et SoloStar :
- Les instructions d'utilisation mentionnées dans la notice doivent être lues avec attention avant toute utilisation. OptiSet et SoloStar doivent être utilisés tel que recommandé dans ces instructions d'utilisation (cf Modalités de manipulation et d'élimination).
INTERACTIONS |
Diverses substances affectent le métabolisme du glucose, ce qui peut exiger un ajustement de la dose d'insuline glargine.
Les médicaments susceptibles de provoquer une augmentation de l'effet hypoglycémiant et de la sensibilité à l'hypoglycémie sont, entre autres, les antidiabétiques oraux, les inhibiteurs de l'enzyme de conversion (IEC), le disopyramide, les fibrates, la fluoxétine, les inhibiteurs de la monoamine-oxydase (IMAO), la pentoxifylline, le propoxyphène, les salicylés et les antibiotiques de type sulfamides.
Les médicaments susceptibles de réduire l'effet hypoglycémiant sont, entre autres, les corticoïdes, le danazol, le diazoxide, les diurétiques, le glucagon, l'isoniazide, les oestrogènes et progestatifs, les phénothiazines, la somatropine, les médicaments sympathomimétiques (par exemple épinéphrine [adrénaline], salbutamol, terbutaline), les hormones thyroïdiennes, les antipsychotiques atypiques (par exemple clozapine et olanzapine) et les inhibiteurs de protéase.
Les bêtabloquants, la clonidine, les sels de lithium et l'alcool peuvent soit potentialiser, soit atténuer l'effet hypoglycémiant de l'insuline. La pentamidine peut provoquer une hypoglycémie, parfois suivie d'une hyperglycémie.
D'autre part, sous l'influence d'agents sympatholytiques tels que les bêtabloquants, la clonidine, la guanéthidine et la réserpine, les signes de réaction adrénergique compensatrice peuvent être atténués, voire absents.
FERTILITÉ/GROSSESSE/ALLAITEMENT |
Pour l'insuline glargine, il n'existe pas de données provenant d'études cliniques contrôlées sur l'utilisation de ce médicament chez la femme enceinte.
Un nombre modéré de données chez des femmes enceintes exposées à l'insuline glargine commercialisée (entre 300 et 1000 résultats de grossesses) n'a révélé aucun effet délétère de l'insuline glargine sur la grossesse, ni aucun effet malformatif, ni aucune toxicité foetale/néonatale de l'insuline glargine.
Les données chez l'animal n'indiquent pas de toxicité reproductive.
L'utilisation de Lantus peut être envisagée durant la grossesse, si nécessaire.
En cas de diabète préexistant ou de diabète gestationnel, il faut impérativement maintenir un bon équilibre métabolique pendant toute la grossesse. Les besoins en insuline peuvent diminuer au cours du 1er trimestre de la grossesse et augmentent généralement pendant le 2e et le 3e trimestre. Immédiatement après l'accouchement, les besoins en insuline diminuent rapidement (risque accru d'hypoglycémie). Une surveillance soigneuse de l'équilibre glycémique est indispensable.
Allaitement :
L'excrétion de l'insuline glargine dans le lait humain est inconnue. Aucun effet métabolique de l'insuline glargine ingérée chez le nouveau-né/le nourrisson allaité n'est anticipé, étant donné que l'insuline glargine, comme tout peptide, est digérée en acides aminés au niveau gastro-intestinal.
Une adaptation de la dose d'insuline et du régime alimentaire peut s'avérer nécessaire pendant l'allaitement.
Fécondité :Les études chez l'animal n'ont révélé aucun effet délétère direct sur la fécondité.
CONDUITE et UTILISATION DE MACHINES |
Les patients doivent être informés des précautions à prendre avant de conduire pour éviter une hypoglycémie, en particulier si les symptômes précurseurs d'hypoglycémie sont absents ou diminués, ou si les épisodes d'hypoglycémie sont fréquents. L'opportunité de conduire une voiture ou d'utiliser une machine doit être évaluée dans de telles circonstances.
EFFETS INDÉSIRABLES |
Les effets indésirables rapportés lors des essais cliniques sont listés ci-dessous, classés par système organe MedDRA et dans l'ordre décroissant des fréquences d'apparition (très fréquent : >= 1/10 ; fréquent : >= 1/100, < 1/10 ; peu fréquent : >= 1/1000, < 1/100 ; rare : >= 1/10 000, < 1/1000 ; très rare : < 1/10 000).
Au sein de chaque fréquence de groupe, les effets indésirables doivent être présentés suivant un ordre décroissant de gravité.
| Affections du système immunitaire | |
| Rare | Réactions allergiques |
| Troubles du métabolisme et de la nutrition | |
| Très fréquent | Hypoglycémie |
| Affections du système nerveux | |
| Très rare | Dysgueusie |
| Affections oculaires | |
| Rare | Altération de la vision, rétinopathie |
| Affections de la peau et du tissu sous-cutané | |
| Fréquent | Lipohypertrophie |
| Peu fréquent | Lipoatrophie |
| Affections musculosquelettiques et systémiques | |
| Très rare | Myalgie |
| Troubles généraux et anomalies au site d'administration | |
| Fréquent | Réactions au site d'injection |
| Rare | OEdème |
- Troubles du métabolisme et de la nutrition :
- Les épisodes d'hypoglycémie sévère, surtout s'ils sont répétés, peuvent entraîner des lésions neurologiques. Les épisodes d'hypoglycémie prolongée ou sévère peuvent engager le pronostic vital.
- Chez de nombreux patients, les signes et symptômes de neuroglycopénie sont précédés par des signes de réaction adrénergique compensatrice. En règle générale, plus la chute de la glycémie est importante et rapide, plus le phénomène de réaction adrénergique compensatrice et ses symptômes sont marqués.
- Affections du système immunitaire :
-
- Les réactions d'hypersensibilité immédiate à l'insuline sont rares. De telles réactions à l'insuline (y compris l'insuline glargine) ou à ses excipients peuvent s'accompagner, par exemple, de réactions cutanées généralisées, d'un oedème de Quincke, d'un bronchospasme, d'une hypotension et d'un choc, et peuvent menacer le pronostic vital.
- L'administration d'insuline peut provoquer la formation d'anticorps anti-insuline. Dans les études cliniques, la fréquence des anticorps provoquant une réaction croisée avec l'insuline humaine et l'insuline glargine a été identique dans les groupes traités par l'insuline NPH et par l'insuline glargine. Dans de rares cas, la présence de ces anticorps anti-insuline peut rendre nécessaire l'ajustement de la dose d'insuline, de manière à corriger une tendance à l'hyper- ou à l'hypoglycémie.
- Les réactions d'hypersensibilité immédiate à l'insuline sont rares. De telles réactions à l'insuline (y compris l'insuline glargine) ou à ses excipients peuvent s'accompagner, par exemple, de réactions cutanées généralisées, d'un oedème de Quincke, d'un bronchospasme, d'une hypotension et d'un choc, et peuvent menacer le pronostic vital.
- Affections oculaires :
-
- Un changement prononcé de l'équilibre glycémique peut entraîner une altération transitoire de la vision, due à une altération temporaire de la turgescence et de l'index de réfraction du cristallin.
- Une amélioration de l'équilibre glycémique à long terme diminue le risque de progression de la rétinopathie diabétique. Toutefois, une intensification de l'insulinothérapie induisant une amélioration brutale de l'équilibre glycémique peut provoquer une aggravation transitoire de la rétinopathie diabétique. Une hypoglycémie sévère risque de provoquer une amaurose transitoire chez les patients atteints de rétinopathie proliférante, en particulier si celle-ci n'a pas été traitée par photocoagulation.
- Un changement prononcé de l'équilibre glycémique peut entraîner une altération transitoire de la vision, due à une altération temporaire de la turgescence et de l'index de réfraction du cristallin.
- Affections de la peau et du tissu sous-cutané :
- Comme avec toute insulinothérapie, une lipodystrophie peut survenir au site d'injection, ce qui peut retarder la résorption locale de l'insuline. Une rotation continue des sites d'injection dans une zone donnée peut aider à diminuer ou à éviter ces réactions.
- Troubles généraux et anomalies au site d'administration :
-
- De telles réactions comprennent rougeur, douleur, prurit, urticaire, tuméfaction ou inflammation. La plupart des réactions mineures à l'insuline au site d'injection disparaissent généralement en l'espace de quelques jours à quelques semaines.
- Dans de rares cas, l'insuline peut provoquer une rétention sodée et un oedème, en particulier si l'équilibre métabolique auparavant médiocre se trouve amélioré par une insulinothérapie intensive.
- De telles réactions comprennent rougeur, douleur, prurit, urticaire, tuméfaction ou inflammation. La plupart des réactions mineures à l'insuline au site d'injection disparaissent généralement en l'espace de quelques jours à quelques semaines.
- Population pédiatrique :
- D'une manière générale, le profil de tolérance est identique chez les enfants et les adolescents (<= 18 ans) et chez les adultes.
- Les rapports sur les effets indésirables reçus au cours de la surveillance post-marketing ont montré une fréquence relativement plus importante des réactions au site d'injection (douleur au point d'injection, réaction au point d'injection) et des réactions cutanées (éruption, urticaire) chez les enfants et les adolescents (<= 18 ans) que chez les adultes.
- Aucune donnée de tolérance issue d'une étude clinique n'est disponible chez les enfants de moins de 6 ans.
SURDOSAGE |
- Symptômes :
- Un surdosage en insuline peut provoquer une hypoglycémie sévère, pouvant se prolonger et menacer le pronostic vital.
- Conduite à tenir :
- On peut généralement traiter les épisodes d'hypoglycémie légère par un apport oral de glucides. Il peut être nécessaire d'ajuster la dose du médicament, le régime ou l'activité physique.
- Les épisodes plus sévères, s'accompagnant de coma, convulsions ou troubles neurologiques, peuvent être traités par du glucagon par voie intramusculaire ou sous-cutanée, ou du glucose concentré par voie intraveineuse. Étant donné qu'une hypoglycémie peut récidiver après une amélioration clinique apparente, il peut être nécessaire de poursuivre l'apport de glucides et la surveillance.
PHARMACODYNAMIE |
Groupe pharmacothérapeutique : Médicaments utilisés dans le diabète. Insuline et ses analogues injectables, d'action lente (code ATC : A10AE04).
L'insuline glargine est un analogue de l'insuline humaine peu soluble à pH neutre. Elle est totalement soluble au pH acide de la solution injectable de Lantus (pH 4). Après injection dans le tissu sous-cutané, la solution acide est neutralisée, ce qui induit la formation de microprécipités à partir desquels de petites quantités d'insuline glargine sont libérées de façon continue. De ce fait, la courbe concentration/temps est régulière, sans pics, prévisible, et la durée d'action est prolongée.
Fixation au récepteur de l'insuline : l'insuline glargine est tout à fait comparable à l'insuline humaine sur le plan de la cinétique de fixation au récepteur de l'insuline. On estime donc qu'elle exerce le même effet par l'intermédiaire du récepteur de l'insuline.
Le principal effet de l'insuline, y compris l'insuline glargine, est de réguler le métabolisme du glucose. L'insuline et ses analogues diminuent la glycémie en stimulant la captation périphérique du glucose, en particulier dans les muscles squelettiques et le tissu adipeux, et en inhibant la production hépatique de glucose. L'insuline inhibe la lipolyse dans l'adipocyte, inhibe la protéolyse et stimule la synthèse des protéines.
Des études de pharmacologie clinique ont montré que des doses identiques d'insuline glargine et d'insuline humaine, administrées par voie intraveineuse, étaient équipotentes. Comme pour toutes les insulines, l'activité physique et d'autres paramètres peuvent affecter le profil d'action en fonction du temps de l'insuline glargine.
Des études de clamp euglycémique menées chez des sujets sains et des patients atteints de diabète de type 1 ont montré que l'effet de l'insuline glargine sous-cutanée apparaissait plus lentement que celui de l'insuline NPH humaine, que cet effet était régulier, sans pics, et que sa durée d'action était prolongée.
| La figure ci-après représente les résultats d'une étude menée chez des patients : |
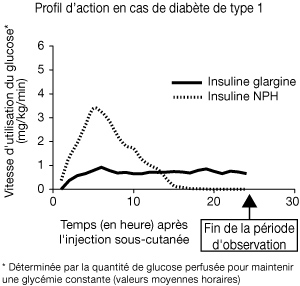 |
Cet effet plus prolongé de l'insuline glargine en sous-cutané est directement lié au fait que la résorption de cette insuline est plus lente. En conséquence, une seule administration par jour suffit. Le profil d'action de l'insuline et des analogues de l'insuline tels que l'insuline glargine peut varier considérablement d'un sujet à l'autre et chez un même sujet.
Dans une étude clinique, les symptômes d'hypoglycémie et des réponses hormonales compensatrices ont été identiques après l'administration intraveineuse d'insuline glargine et d'insuline humaine, tant chez des volontaires sains que chez des patients atteints de diabète de type 1.
Les effets de l'insuline glargine (1 injection par jour) sur la rétinopathie diabétique ont été évalués sur 5 ans dans une étude en ouvert contrôlée versus NPH (administré 2 fois par jour) chez 1024 patients diabétiques de type 2 et dont la progression de la rétinopathie de 3 points ou plus sur l'échelle ETDRS (Early Treatment Diabetic Retinopathy Study) a été recherchée par photographie du fond d'oeil. Aucune différence significative n'a été observée dans la progression de la rétinopathie diabétique quand l'insuline glargine a été comparée à l'insuline NPH.
- Population pédiatrique :
- Dans une étude clinique randomisée contrôlée, des enfants et des adolescents (6-15 ans) diabétiques de type 1 (n = 349) ont été traités pendant 28 semaines par un schéma de type basal/bolus, avec une insuline rapide humaine avant chaque repas. L'insuline glargine était administrée une fois par jour au coucher et l'insuline NPH humaine était administrée une ou deux fois par jour. Les effets sur l'hémoglobine glyquée et l'incidence des hypoglycémies symptomatiques ont été similaires entre les deux groupes de traitement, cependant la glycémie à jeun a plus diminué par rapport à sa valeur initiale avec l'insuline glargine qu'avec l'insuline NPH. Il y a eu aussi moins d'hypoglycémies sévères avec l'insuline glargine. Cent quarante-trois des patients traités par l'insuline glargine dans cette étude ont continué leur traitement par insuline glargine lors d'une extension non contrôlée de l'étude, avec une durée moyenne de suivi de 2 ans. Aucun nouveau signal de sécurité n'a été repéré durant l'extension du traitement par insuline glargine.
- Une étude en cross-over chez 26 adolescents diabétiques de type 1 âgés de 12 à 18 ans comparant l'insuline glargine avec de l'insuline lispro à l'insuline NPH avec de l'insuline rapide humaine (chaque traitement étant administré pendant 16 semaines dans un ordre aléatoire) a également été menée. Comme dans l'étude pédiatrique décrite ci-dessus, la réduction de la glycémie à jeun par rapport à sa valeur initiale a été plus importante avec l'insuline glargine qu'avec l'insuline NPH. Les variations d'HbA1c par rapport à la valeur initiale ont été similaires entre les deux groupes de traitement, cependant les valeurs glycémiques enregistrées durant la nuit ont été significativement plus élevées dans le groupe insuline glargine/insuline lispro que dans le groupe insuline NPH/insuline rapide humaine, avec un nadir moyen de 5,4 mmol/l contre 4,1 mmol/l. En conséquence, les incidences des hypoglycémies nocturnes ont été de 32 % dans le groupe insuline glargine/insuline lispro contre 52 % dans le groupe insuline NPH/insuline humaine rapide.
PHARMACOCINÉTIQUE |
Chez des sujets sains comme chez des diabétiques, l'analyse des concentrations sériques d'insuline a montré que la résorption de l'insuline glargine était plus lente et beaucoup plus prolongée que celle de l'insuline NPH humaine et qu'il n'y avait pas de pic après injection sous-cutanée d'insuline glargine. Autrement dit, les concentrations étaient conformes au déroulement chronologique de l'activité pharmacodynamique de l'insuline glargine. La figure ci-dessus permet de comparer le profil de l'activité de l'insuline glargine et de l'insuline NPH en fonction du temps.
L'insuline glargine administrée une fois par jour atteindra l'« état d'équilibre » en 2 à 4 jours après la première injection.
Après administration intraveineuse, les demi-vies d'élimination apparentes de l'insuline glargine et de l'insuline humaine sont comparables.
Chez l'homme, l'insuline glargine est partiellement dégradée dans le tissu sous-cutané, au niveau de l'extrémité carboxyle de la chaîne bêta ; cette dégradation donne naissance à deux métabolites actifs, la 21A-Gly-insuline et la 21A-Gly-des-30B-Thr-insuline. On trouve aussi de l'insuline glargine inchangée et des produits de dégradation dans le plasma.
Dans les études cliniques, les analyses de sous-groupes (selon l'âge et le sexe) ne montrent aucune différence, en termes de tolérance ou d'efficacité, entre l'ensemble de la population étudiée et les différents sous-groupes de patients traités par l'insuline glargine.
- Population pédiatrique :
- Aucune étude pharmacocinétique spécifique n'a été menée chez des enfants ou des adolescents.
SÉCURITE PRÉCLINIQUE |
Les données non cliniques issues des études conventionnelles de pharmacologie de sécurité, toxicologie en administration répétée, génotoxicité, cancérogenèse, et des fonctions de reproduction n'ont pas révélé de risque particulier pour l'homme.
INCOMPATIBILITÉS |
Ce médicament ne doit pas être mélangé avec d'autres médicaments.
Il importe de vérifier que les seringues ne contiennent aucune trace d'autre produit.
CONDITIONS DE CONSERVATION |
- Avant ouverture :
- A conserver au réfrigérateur (entre 2 °C et 8 °C). Ne pas congeler.
- Conserver le flacon, la cartouche ou le stylo prérempli dans l'emballage extérieur, à l'abri de la lumière.
- Ne pas mettre Lantus à côté du compartiment congélateur ou d'une poche de congélation.
- En cours d'utilisation :
-
- Durée de conservation après la 1re ouverture/1re utilisation du flacon, des cartouches ou des stylos préremplis :
- Ce médicament peut être conservé jusqu'à 4 semaines maximum, à une température ne dépassant pas + 25 °C, à l'abri de la chaleur directe ou de la lumière directe.
-
- Flacon :
- A conserver dans l'emballage extérieur, à l'abri de la lumière. Il est recommandé d'inscrire la date de première utilisation du flacon sur l'étiquette.
-
- Cartouches et stylos :
- Ne pas conserver les stylos contenant une cartouche ou les stylos préremplis en cours d'utilisation au réfrigérateur. Le capuchon du stylo doit être remis sur le stylo après chaque injection afin de le protéger de la lumière.
MODALITÉS MANIPULATION/ÉLIMINATION |
Examiner les flacons, les cartouches et les stylos avant l'emploi. Ne les utiliser que si la solution est limpide, incolore, sans particules solides visibles, et a l'aspect de l'eau. Comme Lantus est une solution, il n'est pas nécessaire de la remettre en suspension avant l'emploi.
Lantus ne doit ni être mélangé avec une autre insuline ni dilué. Le mélange ou la dilution peuvent changer sa durée d'action et le mélange peut provoquer une précipitation.
L'étiquette de l'insuline doit toujours être vérifiée avant chaque injection pour éviter les erreurs médicamenteuses entre l'insuline glargine et d'autres insulines (cf Mises en garde et Précautions d'emploi).
- Cartouches pour stylos :
- Les cartouches Lantus doivent être utilisées uniquement avec OptiPen, ClikStar, Autopen 24 ou Tactipen (cf Mises en garde et Précautions d'emploi). Tous ces stylos peuvent ne pas être commercialisés dans un pays.
- Le stylo doit être utilisé conformément aux instructions du fabricant du dispositif.
- Les instructions du fabricant pour l'utilisation du stylo doivent être soigneusement suivies pour l'insertion de la cartouche, la fixation de l'aiguille et l'injection d'insuline.
- Si le stylo à insuline est défectueux ou ne fonctionne pas correctement (dû à des défauts mécaniques), il doit être écarté, et un nouveau stylo doit être utilisé.
- En cas de mauvais fonctionnement du stylo (voir le mode d'emploi du stylo), la solution peut être prélevée de la cartouche à l'aide d'une seringue (adaptée à une insuline concentrée à 100 unités/ml) et injectée.
- Avant l'injection, éliminer les bulles d'air de la cartouche (voir le mode d'emploi du stylo). Ne pas remplir à nouveau les cartouches vides.
- Avant l'insertion de la cartouche dans le stylo ou avant la première utilisation, la cartouche ou le stylo doivent être conservés à température ambiante 1 à 2 heures.
- Stylos préremplis OptiSet et SoloStar :
- Les stylos vides ne doivent jamais être réutilisés et devront être jetés de manière appropriée.
- Afin de prévenir la transmission éventuelle de maladies, chaque stylo ne doit être utilisé que par un seul patient.
- Il doit être conseillé aux patients de lire avec attention les instructions d'utilisation mentionnées dans la notice avant toute utilisation d'OptiSet ou de Solostar.
-
- Informations importantes pour l'utilisation des stylos OptiSet ou SoloStar :
-
- Une aiguille neuve doit toujours être soigneusement fixée avant chaque utilisation. Seules des aiguilles compatibles avec OptiSet ou SoloStar doivent être utilisées.
- Un test de sécurité doit toujours être effectué avant chaque injection.
- OptiSet : Si un nouvel OptiSet est utilisé, le test initial de sécurité doit être effectué avec les 8 unités présélectionnées par le fabricant. Le sélecteur de dose ne peut être tourné que dans un seul sens. Le sélecteur de dose (pour changer la dose) ne doit jamais être tourné après avoir tiré le bouton d'injection. Ce stylo OptiSet est destiné à l'utilisation d'un seul patient et ne doit pas être partagé entre plusieurs personnes. Si l'injection est faite par un tiers, cette personne doit prendre des précautions particulières afin d'éviter toute blessure accidentelle avec l'aiguille ainsi que tout risque de transmission infectieuse.
- SoloStar : Prendre des précautions particulières afin d'éviter toute blessure accidentelle avec l'aiguille et tout risque de transmission infectieuse.
- OptiSet ou SoloStar ne doivent jamais être utilisés s'ils sont endommagés ou si le patient n'est pas certain qu'ils fonctionnent correctement.
- Le patient doit toujours disposer d'un OptiSet ou d'un SoloStar de rechange au cas où l'OptiSet ou le SoloStar seraient endommagés ou égarés.
- Une aiguille neuve doit toujours être soigneusement fixée avant chaque utilisation. Seules des aiguilles compatibles avec OptiSet ou SoloStar doivent être utilisées.
-
- Conservation des stylos OptiSet et SoloStar :
-
- Se reporter à la rubrique Conditions de conservation de ce RCP pour les instructions de conservation d'OptiSet et de SoloStar.
- Si OptiSet et SoloStar sont conservés dans un endroit frais, ils doivent être sortis 1 à 2 heures avant l'injection afin de les réchauffer. L'injection d'une insuline qui n'est pas à température ambiante est plus douloureuse. Un OptiSet ou un SoloStar usagés doivent être jetés comme recommandé par les autorités locales.
- Se reporter à la rubrique Conditions de conservation de ce RCP pour les instructions de conservation d'OptiSet et de SoloStar.
-
- Entretien des stylos préremplis OptiSet et SoloStar :
-
- OptiSet et SoloStar doivent être protégés de la poussière et de la saleté.
- L'extérieur d'OptiSet et de SoloStar peuvent être nettoyés en les essuyant avec un linge humide.
- Les stylos ne doivent pas être trempés, ni lavés ou lubrifiés car cela risquerait de les endommager.
- OptiSet et SoloStar sont conçus pour fonctionner avec précision et en toute sécurité. Ils doivent être manipulés avec précaution. Le patient doit éviter les situations où OptiSet et SoloStar pourraient être endommagés. Si le patient pense qu'OptiSet ou que SoloStar ont pu être endommagés, il doit en utiliser de nouveaux.
- OptiSet et SoloStar doivent être protégés de la poussière et de la saleté.
-
- Manipulation du stylo prérempli OptiSet :
-
- Étape 1 : Vérifier l'insuline :
Après avoir retiré le capuchon du stylo, vérifier les mentions portées sur le réservoir d'insuline afin de s'assurer qu'il s'agit de la bonne insuline. Examiner également l'aspect de l'insuline : l'insuline en solution doit être limpide, incolore, sans particules solides visibles et avoir l'aspect de l'eau. Ne pas utiliser OptiSet si l'insuline est trouble, colorée ou contient des particules.
- Étape 2 : Fixer l'aiguille :
L'aiguille doit être soigneusement fixée de façon bien droite sur le stylo.
- Étape 3 : Effectuer un test de sécurité :
Avant chaque injection, un test de sécurité doit être effectué.
Avec un OptiSet neuf et n'ayant jamais servi, une dose de 8 unités est déjà présélectionnée par le fabricant, pour le premier test de sécurité.
Avec un OptiSet en cours d'utilisation, une dose de 2 unités doit être sélectionnée en tournant le sélecteur de dose dans le sens des aiguilles d'une montre jusqu'à ce que la flèche indicatrice de la dose indique le chiffre 2. Le sélecteur de dose ne peut tourner que dans un seul sens.
Le bouton d'injection doit être tiré à fond afin de charger la dose. Le sélecteur de dose ne doit jamais être tourné après avoir tiré le bouton d'injection.
Les capuchons extérieur et intérieur de l'aiguille doivent être retirés. Le capuchon extérieur doit être conservé pour retirer l'aiguille usagée.
Afin que toute éventuelle bulle d'air remonte vers l'aiguille, le réservoir d'insuline doit être tapoté avec le doigt tout en maintenant le stylo avec l'aiguille pointée vers le haut.
Le bouton d'injection doit alors être poussé à fond.
Si l'insuline a été expulsée à l'extrémité de l'aiguille, alors le stylo et l'aiguille fonctionnent correctement.
Si aucune insuline n'apparaît à l'extrémité de l'aiguille, répéter l'étape 3 deux fois de plus jusqu'à ce que de l'insuline apparaisse à l'extrémité de l'aiguille. Si l'insuline ne sort toujours pas, changer l'aiguille car elle peut être bouchée et réessayer. Si l'insuline ne sort pas après le changement de l'aiguille, l'OptiSet est peut-être endommagé. Cet OptiSet ne doit pas être utilisé.
- Étape 4 : Sélectionner la dose d'insuline :
La sélection de la dose s'effectue par intervalles de 2 unités, d'un minimum de 2 unités à un maximum de 40 unités. Si une dose supérieure à 40 unités est souhaitée, elle devra être administrée en deux ou plus de deux injections.
Le patient doit toujours vérifier qu'il a suffisamment d'insuline pour la dose.
L'échelle indicatrice de l'insuline résiduelle figurant sur le réservoir transparent d'insuline indique approximativement combien d'insuline reste dans OptiSet. Cette échelle ne doit pas être utilisée pour sélectionner la dose d'insuline.
Si le piston noir se trouve au début de la marque colorée, alors il y a environ 40 unités d'insuline disponible. Si le piston noir se trouve à la fin de la marque colorée, alors il y a environ 20 unités d'insuline disponible.
Le sélecteur de dose doit être tourné dans le sens des aiguilles d'une montre jusqu'à ce que la flèche indicatrice de la dose indique la dose souhaitée.
- Étape 5 : Charger la dose d'insuline :
Le bouton d'injection doit être tiré aussi loin que possible pour charger le stylo.
Le patient doit toujours vérifier que la dose sélectionnée est complètement chargée. Le bouton d'injection sort seulement aussi loin que la quantité d'insuline restant dans le réservoir.
Le bouton d'injection permet de vérifier la dose réellement chargée et doit être maintenu tiré sous tension pendant cette vérification. Le dernier trait épais visible sur le bouton d'injection indique la quantité d'insuline chargée. Lorsque le bouton d'injection est maintenu tiré, seul le haut de ce trait épais est visible.
- Étape 6 : Injecter la dose :
Le patient doit être éduqué sur les techniques d'injection par son professionnel de santé.
L'aiguille doit être introduite dans la peau.
Le bouton d'injection doit être enfoncé à fond. Un clic est perceptible et s'arrête quand le bouton d'injection est complètement enfoncé. Le bouton d'injection doit ensuite être maintenu enfoncé pendant 10 secondes avant de retirer l'aiguille de la peau. Ceci garantit que la dose entière a été injectée.
- Étape 7 : Retirer et jeter l'aiguille :
Après chaque injection, l'aiguille doit être retirée et éliminée. Cette mesure vise à prévenir tout risque de contamination et/ou d'infection, d'entrée d'air dans le réservoir d'insuline et de fuites d'insuline qui peuvent être à l'origine de doses inexactes. Les aiguilles ne doivent pas être réutilisées.
Le capuchon du stylo doit être replacé sur le stylo.
- Étape 1 : Vérifier l'insuline :
-
- Manipulation du stylo prérempli SoloStar :
-
- Étape 1 : Vérification de l'insuline :
Vérifier l'étiquette du stylo afin de s'assurer qu'il contient la bonne insuline. Le stylo Lantus SoloStar est gris avec un bouton d'injection violet. Après avoir retiré le capuchon du stylo, examiner également l'apparence de l'insuline : elle doit être limpide, incolore, sans particules solides visibles et avoir l'aspect de l'eau.
- Étape 2 : Fixation de l'aiguille :
N'utiliser que des aiguilles approuvées pour être utilisées avec SoloStar.
Utiliser toujours une aiguille neuve stérile avant chaque injection. Après avoir retiré le capuchon, l'aiguille doit être soigneusement fixée de façon bien droite sur le stylo.
- Étape 3 : Test de sécurité :
Avant chaque injection un test de sécurité doit être effectué afin de s'assurer que le stylo et l'aiguille fonctionnent correctement et pour éliminer les bulles d'air.
Une dose de 2 unités doit être sélectionnée. Retirer les capuchons extérieur et intérieur de l'aiguille.
Tout en maintenant le stylo avec l'aiguille pointée vers le haut, tapoter doucement le réservoir à insuline avec le doigt afin que toute éventuelle bulle d'air remonte vers l'aiguille.
Appuyer alors à fond sur le bouton d'injection.
Si l'insuline a été expulsée à l'extrémité de l'aiguille, alors le stylo et l'aiguille fonctionnent correctement.
Si aucune insuline n'apparaît à l'extrémité de l'aiguille, répéter l'étape 3 jusqu'à ce que de l'insuline apparaisse à l'extrémité de l'aiguille.
- Étape 4 : Réglage de la dose :
La sélection de la dose s'effectue par intervalles de 1 unité, d'un minimum de 1 unité à un maximum de 80 unités. Si une dose supérieure à 80 unités est nécessaire, elle devra être administrée en deux ou plus de deux injections.
Après avoir effectué le test de sécurité, le chiffre « 0 » doit apparaître sur la fenêtre d'affichage de la dose. La dose peut alors être sélectionnée.
- Étape 5 : Injection de la dose :
Le patient doit être éduqué sur les techniques d'injection par son professionnel de santé.
L'aiguille doit être introduite dans la peau.
Le bouton d'injection doit être enfoncé à fond. Le bouton d'injection doit ensuite être maintenu enfoncé pendant 10 secondes avant de retirer l'aiguille. Ceci garantit que la dose entière a été injectée.
- Étape 6 : Retrait et élimination de l'aiguille :
Après chaque injection, l'aiguille doit toujours être retirée et éliminée. Cette mesure préviendra tout risque de contamination et/ou d'infection, d'entrée d'air dans le réservoir à insuline et de fuite d'insuline. Les aiguilles ne doivent pas être réutilisées.
Prendre des précautions particulières concernant le retrait et l'élimination de l'aiguille. Les mesures de sécurité recommandées pour le retrait et l'élimination des aiguilles doivent être suivies afin de réduire le risque de blessure accidentelle avec l'aiguille et la transmission de maladies infectieuses. Le capuchon du stylo doit être replacé sur le stylo.
- Étape 1 : Vérification de l'insuline :
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| AMM | EU/1/00/134/012 ; CIP 3400935946492 (flacon). |
| EU/1/00/134/006 ; CIP 3400935463203 (cartouche). | |
| EU/1/00/134/010 ; CIP 3400935651976 (stylo OptiSet). | |
| EU/1/00/134/033 ; CIP 3400937722988 (stylo SoloStar). | |
| RCP révisés le 24.01.2011. | |
| Prix : | 46.68 euros (1 flacon de 10 ml). |
| 67.41 euros (5 cartouches de 3 ml). | |
| 67.41 euros (5 stylos préremplis OptiSet). | |
| 67.41 euros (5 stylos préremplis SoloStar). | |
| Remb Séc soc à 65 %. Collect. | |
sanofi-aventis France
1-13, bd Romain-Rolland. 75014 Paris
Info médic et pharmacovigilance :
Tél (n° Vert) : 08 00 39 40 00
Fax : 01 57 62 06 62
Service stylos injecteurs d'insulines :
Tél (n° Vert) : 08 00 10 52 53
