ENBREL®
étanercept
FORMES et PRÉSENTATIONS |
Solution injectable SC (limpide, incolore ou jaune pâle) à 50 mg : Coffret de 4 stylos préremplis (Myclic)* + 8 tampons alcoolisés. * Le capuchon du stylo contient du caoutchouc naturel (latex).
Poudre (blanche) et solvant (limpide et incolore) pour solution injectable SC à 25 mg/ml pour usage pédiatrique : Coffret de 4 flacons de poudre + 4 seringues préremplies de solvant + 8 seringues vides + 20 aiguilles + 24 tampons alcoolisés.
Poudre (blanche) et solvant (limpide et incolore) pour solution injectable SC à 25 mg : Coffret de 4 flacons de poudre + 4 seringues préremplies de solvant + 4 aiguilles + 4 adaptateurs pour flacon + 8 tampons alcoolisés.
COMPOSITION |
Solution injectable à 25 mg et à 50 mg :
| Solution injectable : | p seringue | p stylo |
| Étanercept (DCI) | 25 mg | |
| ou | 50 mg | 50 mg |
| Poudre : | p flacon |
| Étanercept (DCI) | 25 mg |
Solvant : eau pour préparations injectables. Conservateur : alcool benzylique (9 mg/ml).
Après reconstitution, la solution contient 25 mg/ml d'étanercept.
Poudre et solvant pour solution injectable à 25 mg :
| Poudre : | p flacon |
| Étanercept (DCI) | 25 mg |
Solvant : eau pour préparations injectables.
L'étanercept est une protéine de fusion du récepteur p75 du facteur nécrosant des tumeurs. L'étanercept est produit par génie génétique et exprimé dans des cellules ovariennes de hamster chinois (CHO). L'étanercept est un dimère d'une protéine chimère génétiquement modifiée qui a été obtenue en fusionnant le domaine de liaison extracellulaire du récepteur 2 humain au facteur nécrosant des tumeurs (TNFR2/p75) et le domaine Fc de l'IgG1 humaine. Ce fragment Fc contient les régions charnières, CH2 et CH3, mais pas la région CH1 de l'IgG1. L'étanercept est constitué de 934 acides aminés et son poids moléculaire apparent est d'environ 150 kilodaltons.
L'activité d'étanercept est déterminée en mesurant sa capacité à neutraliser l'inhibition de la croissance des cellules A375 médiée par le TNFalpha. L'activité spécifique d'étanercept est de 1,7 × 106 unités/mg.
INDICATIONS |
- Seringues préremplies à 25 mg et à 50 mg, stylo prérempli à 50 mg et flacon à 25 mg :
-
- Polyarthrite rhumatoïde :
-
- Enbrel en association au méthotrexate est indiqué pour le traitement de la polyarthrite rhumatoïde modérément à sévèrement active de l'adulte en cas de réponse inadéquate aux traitements de fond, y compris le méthotrexate (sauf contre-indication).
- Enbrel peut être donné en monothérapie en cas d'intolérance au méthotrexate ou lorsque la poursuite du traitement avec le méthotrexate est inadaptée.
- Enbrel est également indiqué dans le traitement de la polyarthrite rhumatoïde sévère, active et évolutive de l'adulte non précédemment traité par le méthotrexate.
- Enbrel en association au méthotrexate est indiqué pour le traitement de la polyarthrite rhumatoïde modérément à sévèrement active de l'adulte en cas de réponse inadéquate aux traitements de fond, y compris le méthotrexate (sauf contre-indication).
- Il a été montré qu'Enbrel, seul ou en association avec le méthotrexate, ralentit la progression des dommages structuraux articulaires tels que mesurés par la radiographie et améliore les capacités fonctionnelles.
-
- Rhumatisme psoriasique :
- Traitement du rhumatisme psoriasique actif et évolutif de l'adulte en cas de réponse inadéquate au traitement de fond antérieur. Il a été montré qu'Enbrel améliore les capacités fonctionnelles chez les patients atteints de rhumatisme psoriasique, et ralentit la progression des dommages structuraux articulaires périphériques tels que mesurés par la radiographie chez les patients ayant des formes polyarticulaires symétriques de la maladie.
-
- Spondylarthrite ankylosante :
- Traitement de la spondylarthrite ankylosante sévère et active de l'adulte en cas de réponse inadéquate au traitement conventionnel.
-
- Psoriasis en plaques :
- Traitement du psoriasis en plaques modéré à sévère de l'adulte en cas d'échec ou de contre-indication ou d'intolérance aux autres traitements systémiques, y compris la ciclosporine, le méthotrexate ou la puvathérapie (cf Pharmacodynamie).
- Seringue préremplie à 25 mg, flacon à 25 mg et flacon à 25 mg/ml pour usage pédiatrique :
-
- Arthrite juvénile idiopathique polyarticulaire :
- Traitement de l'arthrite juvénile idiopathique polyarticulaire active de l'enfant à partir de 4 ans et de l'adolescent en cas de réponse inadéquate ou d'intolérance avérée au méthotrexate. Enbrel n'a pas été étudié chez l'enfant de moins de 4 ans.
- Seringues préremplies à 25 mg et à 50 mg, stylo prérempli à 50 mg, flacon à 25 mg et flacon à 25 mg/ml pour usage pédiatrique :
-
- Psoriasis en plaques de l'enfant :
- Traitement du psoriasis en plaques sévère chronique de l'enfant à partir de 8 ans et de l'adolescent en cas de contrôle inadéquat, ou d'intolérance aux autres traitements systémiques ou à la photothérapie.
POSOLOGIE ET MODE D'ADMINISTRATION |
Enbrel est disponible en dosages de 25 mg et de 50 mg.
Posologie :
- Polyarthrite rhumatoïde :
- La dose recommandée d'Enbrel est de 25 mg, administrés deux fois par semaine. Toutefois, l'efficacité et la sécurité d'emploi d'une administration de 50 mg une fois par semaine ont été démontrées (cf Pharmacodynamie).
- Coût du traitement pour 50 mg/semaine : 252,03 euro(s) (Enbrel 50 mg en ser préremplie ou 50 mg en stylo prérempli) ou 258,45 euro(s) (Enbrel 25 mg en ser préremplie ou 25 mg en pdre et solv p sol inj).
- Rhumatisme psoriasique et spondylarthrite ankylosante :
- La dose recommandée est de 25 mg d'Enbrel administrés deux fois par semaine ou de 50 mg administrés une fois par semaine.
- Coût du traitement pour 50 mg/semaine : 252,03 euro(s) (Enbrel 50 mg en ser préremplie ou 50 mg en stylo prérempli) ou 258,45 euro(s) (Enbrel 25 mg en ser préremplie ou 25 mg en pdre et solv p sol inj).
- Psoriasis en plaques :
- La dose recommandée d'Enbrel est de 25 mg administrés deux fois par semaine ou 50 mg administrés une fois par semaine. Toutefois, une administration de 50 mg deux fois par semaine peut être utilisée jusqu'à 12 semaines, suivie, si nécessaire, par l'administration d'une dose de 25 mg deux fois par semaine ou 50 mg une fois par semaine. Le traitement par Enbrel doit être poursuivi jusqu'à l'obtention de la rémission, au maximum jusqu'à 24 semaines. Un traitement continu au-delà de 24 semaines peut être approprié pour certains patients adultes (cf Pharmacodynamie). Le traitement par Enbrel doit être interrompu chez les patients ne présentant pas de réponse après 12 semaines de traitement.
- Si la reprise du traitement par Enbrel est indiquée, le même schéma de durée de traitement doit être suivi. La dose doit être de 25 mg administrés deux fois par semaine ou 50 mg une fois par semaine.
- Coût du traitement pour 50 mg/semaine : 252,03 euro(s) (Enbrel 50 mg en ser préremplie ou 50 mg en stylo prérempli) ou 258,45 euro(s) (Enbrel 25 mg en ser préremplie ou 25 mg en pdre et solv p sol inj).
- Populations particulières :
-
- Sujets âgés (>= 65 ans) :
- Aucun ajustement posologique n'est nécessaire. La posologie et l'administration sont identiques à celles de l'adulte âgé de 18 à 64 ans.
-
- Population pédiatrique :
- La dose d'Enbrel dépend du poids des patients pédiatriques.
- Les patients pesant moins de 62,5 kg doivent recevoir une dose exacte calculée en mg/kg en utilisant Enbrel 25 mg/ml poudre et solvant pour solution injectable pour usage pédiatrique (cf ci-dessous pour les doses en fonction des indications).
- Les patients pesant 62,5 kg ou plus peuvent recevoir une dose fixe en utilisant la seringue préremplie ou le stylo prérempli (50 mg/semaine).
- Flacon à 25 mg/ml pour usage pédiatrique : chaque flacon d'Enbrel 25 mg/ml pour usage pédiatrique doit être utilisé pour 2 doses au maximum, administrées au même patient.
-
- Arthrite juvénile idiopathique (4 ans et plus) :
La dose recommandée est de 0,4 mg/kg (au maximum 25 mg par injection) administré deux fois par semaine en injection sous-cutanée, avec un intervalle de 3 à 4 jours entre deux injections.
- Flacon à 25 mg ou seringue préremplie à usage unique à 25 mg pour les patients pesant 62,5 kg ou plus.
- Flacon à 25 mg/ml pour administrer des doses de moins de 25 mg après reconstitution de 25 mg dans 1 ml de solvant.
- Flacon à 25 mg ou seringue préremplie à usage unique à 25 mg pour les patients pesant 62,5 kg ou plus.
- Psoriasis en plaques de l'enfant (8 ans et plus) :
La dose recommandée est de 0,8 mg/kg (au maximum 50 mg par injection) une fois par semaine jusqu'à 24 semaines.
- Flacon à 25 mg ou seringue préremplie à 25 mg.
- Seringue préremplie ou stylo à usage unique à 50 mg pour les patients pesant 62,5 kg ou plus.
- Flacon à 25 mg/ml pour administrer des doses de moins de 25 mg après reconstitution de 25 mg dans 1 ml de solvant.
- Flacon à 25 mg ou seringue préremplie à 25 mg.
- Arthrite juvénile idiopathique (4 ans et plus) :
- Le traitement doit être interrompu chez les patients ne présentant pas de réponse après 12 semaines de traitement.
- Si la reprise du traitement par Enbrel est indiquée, le schéma de durée du traitement décrit ci-dessus doit être suivi. La dose doit être de 0,8 mg/kg (au maximum 50 mg par injection) une fois par semaine.
- Coût maximal du traitement pour 50 mg/semaine : 252,03 euro(s) (Enbrel 50 mg en ser préremplie ou 50 mg en stylo prérempli) ou 258,45 euro(s) (Enbrel 25 mg en ser préremplie ou 25 mg en pdre et solv p sol inj, ou 25 mg/ml p usage pédiatrique).
-
- Insuffisants rénaux et hépatiques :
- Aucun ajustement posologique n'est nécessaire.
Mode d'administration :
Enbrel est administré par injection sous-cutanée.
Des instructions complètes pour l'administration de la seringue préremplie, pour l'administration et l'utilisation du stylo prérempli Myclic ou pour la préparation, l'administration et la réutilisation du flacon reconstitué d'Enbrel sont données dans la notice.
CONTRE-INDICATIONS |
- Hypersensibilité à la substance active ou à l'un des excipients.
- Septicémie ou risque de septicémie.
- Un traitement par Enbrel ne devrait pas être initié chez les patients ayant une infection évolutive, y compris les infections chroniques ou localisées.
- Enbrel 25 mg/ml pour usage pédiatrique ne doit pas être administré chez les prématurés ou les nouveau-nés à terme car le solvant contient de l'alcool benzylique.
MISES EN GARDE et PRÉCAUTIONS D'EMPLOI |
- Infections :
- Les infections doivent être recherchées chez les patients avant, pendant, et après le traitement par Enbrel, en prenant en compte que la demi-vie d'élimination moyenne d'étanercept est approximativement de 70 heures (entre 7 et 300 heures).
- Des infections graves, septicémies, tuberculoses, et infections opportunistes, y compris des infections fongiques invasives, ont été rapportées avec Enbrel (cf Effets indésirables). Ces infections étaient dues à des bactéries, des mycobactéries, des champignons, ou à des virus. Dans certains cas, des infections fongiques particulières et d'autres infections opportunistes n'ont pas été diagnostiquées, ce qui s'est traduit par un retard d'initiation du traitement approprié et parfois un décès. Lors de l'évaluation du risque d'infection chez un patient, son exposition à des facteurs de risque spécifiquement associés à certaines infections opportunistes (par exemple une exposition à des mycoses endémiques) doit être prise en compte.
- Une surveillance attentive doit être exercée chez les patients traités par Enbrel développant une nouvelle infection. Le traitement par Enbrel doit être interrompu si le patient développe une infection grave. La sécurité d'emploi et l'efficacité d'Enbrel chez les patients atteints d'infections chroniques n'ont pas été évaluées. Les médecins doivent prescrire Enbrel avec précaution aux patients ayant des antécédents d'infections récurrentes ou chroniques, ou ayant un terrain prédisposant aux infections, comme un diabète sévère ou mal équilibré.
- Tuberculose :
- Des cas de tuberculose active comprenant des tuberculoses miliaires et des tuberculoses avec localisation extrapulmonaire ont été rapportés chez des patients traités par Enbrel. Avant de débuter un traitement par Enbrel, une recherche de tuberculose active ou inactive (latente) doit être effectuée chez tous les patients. Cette recherche doit comprendre un entretien médical détaillé portant sur les antécédents personnels de tuberculose ou sur d'éventuels contacts antérieurs avec un patient tuberculeux et sur un traitement immunosuppresseur ancien et/ou en cours. Des tests de dépistage appropriés, par exemple un test dermique à la tuberculine et une radiographie pulmonaire, devront être effectués chez tous les patients (conformément aux recommandations locales). Il est recommandé de reporter la réalisation de ces examens sur la carte de surveillance du patient. Il est rappelé aux prescripteurs que le test dermique à la tuberculine peut s'avérer faussement négatif, en particulier chez un patient sévèrement malade ou immunodéprimé.
- Si une tuberculose active est diagnostiquée, le traitement par Enbrel ne doit pas être instauré. En cas de diagnostic d'une tuberculose inactive (latente), un traitement antituberculeux prophylactique approprié doit être mis en oeuvre avant d'initier Enbrel, et en accord avec les recommandations locales. Dans un tel cas, le rapport bénéfice/risque du traitement par Enbrel doit être soigneusement évalué.
- Tous les patients devront être informés de la nécessité de consulter un médecin si des signes ou des symptômes évoquant une tuberculose (par exemple, toux persistante, amaigrissement/perte de poids, fébricule) apparaissent pendant ou après le traitement par Enbrel.
- Réactivation du virus de l'hépatite B :
- Une réactivation du virus de l'hépatite B (VHB) a été rapportée chez des patients porteurs chroniques de ce virus qui ont reçu un antagoniste du TNF y compris Enbrel. Les patients à risque d'infection par le VHB devront faire l'objet d'un dépistage préalable d'infection à VHB avant l'initiation d'un traitement par Enbrel. Des précautions devront être prises lors de l'administration d'Enbrel à des patients identifiés comme porteurs du VHB. Si Enbrel est utilisé chez des porteurs du VHB, il faudra surveiller attentivement les signes et les symptômes d'une infection active par le VHB et, si nécessaire, un traitement approprié devra être initié.
- Aggravation d'hépatite C :
- Des cas d'aggravation d'hépatite C ont été rapportés chez les patients recevant Enbrel. Enbrel doit être utilisé avec précaution chez les patients présentant des antécédents d'hépatite C.
- Traitement concomitant avec l'anakinra :
- L'administration concomitante d'Enbrel et de l'anakinra a été associée à une augmentation du risque d'infections graves et de neutropénies comparativement à Enbrel lorsqu'il est administré seul. Cette association n'a pas démontré un bénéfice clinique supérieur. Par conséquent, l'association d'Enbrel et de l'anakinra n'est pas recommandée (cf Interactions, Effets indésirables).
- Traitement concomitant avec l'abatacept :
- L'administration concomitante de l'abatacept et d'Enbrel au cours d'études cliniques a entraîné une augmentation de l'incidence des événements indésirables graves. Cette association n'a pas démontré de bénéfice clinique supplémentaire ; par conséquent, cette association n'est pas recommandée (cf Interactions).
- Réactions allergiques :
- Des réactions allergiques associées à l'administration d'Enbrel ont été fréquemment rapportées. Ces réactions allergiques ont inclus des cas d'angioedème et d'urticaire ; des réactions graves se sont produites. En cas de réaction allergique grave ou de réaction anaphylactique, le traitement par Enbrel doit être interrompu immédiatement et un traitement approprié doit être institué.
- Le protège-aiguille de la seringue préremplie et le capuchon du stylo prérempli contiennent du latex (caoutchouc naturel) pouvant causer des réactions d'hypersensibilité lors de sa manipulation ou lorsque Enbrel est administré chez des personnes présentant une sensibilité au latex connue ou possible.
- Immunosuppression :
- Il est possible que les antagonistes du TNF, y compris Enbrel, altèrent les défenses immunitaires du patient à l'encontre des infections et des tumeurs malignes, d'autant que le TNF est un médiateur de l'inflammation et qu'il module la réponse immunitaire des cellules. Dans une étude de 49 patients adultes atteints de polyarthrite rhumatoïde traités par Enbrel, aucune diminution d'hypersensibilité retardée, des taux d'immunoglobuline ou de changement dans la numération de la formule sanguine n'a été observée.
- Deux patients atteints d'arthrite juvénile idiopathique ont développé une varicelle avec des signes et des symptômes de méningite aseptique suivie d'une guérison sans séquelle. Les patients exposés au virus de la varicelle doivent temporairement arrêter leur traitement par Enbrel et un traitement prophylactique par immunoglobulines spécifiques doit être envisagé.
- La tolérance et l'efficacité d'Enbrel chez des patients immunodéprimés n'ont pas été évaluées.
- Tumeurs malignes et troubles lymphoprolifératifs :
-
- Tumeurs solides et troubles hématopoïétiques (à l'exclusion des cancers cutanés) :
Divers cas de tumeurs malignes (cancer du sein, du poumon, lymphome) ont été rapportés après commercialisation (cf Effets indésirables).
Dans les phases contrôlées des essais cliniques avec des anti-TNF, il a été observé plus de cas de lymphomes parmi les patients ayant reçu un anti-TNF que chez les patients contrôle. Cependant, la survenue était rare et la période de suivi des patients sous placebo était plus courte que celle des patients ayant reçu un traitement par anti-TNF. Après commercialisation, des cas de leucémie ont été rapportés chez des patients traités par anti-TNF. Il existe un risque accru de développer un lymphome ou une leucémie chez les patients atteints de polyarthrite rhumatoïde quand la maladie est ancienne, hautement active et inflammatoire, ce qui complique l'évaluation du risque.
Dans l'état actuel des connaissances, la possibilité d'un risque de développer des lymphomes, des leucémies ou d'autres tumeurs malignes solides ou hématopoïétiques chez les patients traités par anti-TNF ne peut être écartée. Des précautions doivent être prises lors de l'utilisation d'un traitement par anti-TNF chez des patients présentant des antécédents de tumeur maligne ou lors de la poursuite du traitement chez des patients qui développent une tumeur maligne.
Des tumeurs malignes, dont certaines d'évolution fatale, ont été rapportées après la commercialisation chez des enfants, des adolescents et des jeunes adultes (jusqu'à 22 ans) traités par anti-TNF incluant Enbrel (initiation du traitement <= 18 ans). Environ la moitié des cas était des lymphomes. Les autres cas correspondaient à d'autres types de tumeurs malignes, incluant des tumeurs malignes rares habituellement associées à une immunosuppression. Le risque de développer des tumeurs malignes chez les enfants et les adolescents traités par anti-TNF ne peut être exclu.
- Cancers cutanés :
Des cas de cancers cutanés mélanomateux et non mélanomateux ont été rapportés chez des patients traités par anti-TNF dont Enbrel. Des cas de carcinomes à cellules de Merkel ont été rarement rapportés après commercialisation chez des patients traités par Enbrel. Des examens périodiques de la peau sont recommandés pour tous les patients, particulièrement ceux qui ont un facteur de risque de cancer cutané.
En combinant les résultats des essais cliniques, un plus grand nombre de cas de cancers cutanés non mélanomateux a été observé chez les patients recevant Enbrel par rapport au groupe contrôle, particulièrement chez les patients atteints de psoriasis.
- Tumeurs solides et troubles hématopoïétiques (à l'exclusion des cancers cutanés) :
- Vaccinations :
- Les vaccins vivants ne doivent pas être administrés à des patients traités par Enbrel. Aucune donnée n'est disponible sur la transmission infectieuse secondaire à l'administration de vaccins vivants chez des patients traités par Enbrel. Il est recommandé que les enfants aient, si possible, leurs vaccinations à jour, conformément au calendrier de vaccination en vigueur, avant d'initier un traitement par Enbrel.
- Dans une étude clinique randomisée, contrôlée versus placebo en double aveugle chez des patients adultes atteints de rhumatisme psoriasique, 184 patients ont également reçu un vaccin pneumococcique polysaccharidique multivalent à la semaine 4. Dans cette étude, la plupart des patients adultes atteints de rhumatisme psoriasique traités par Enbrel étaient capables d'augmenter la réponse immunitaire des cellules B activées au vaccin pneumococcique polysaccharidique ; cependant, les titres en agrégat étaient modérément bas et quelques patients avaient augmenté leur titre d'un facteur 2 par rapport aux patients qui n'étaient pas traités par Enbrel. La signification clinique de ces résultats est inconnue.
- Formation d'auto-anticorps :
- Enbrel est susceptible d'entraîner la formation d'anticorps auto-immuns (cf Effets indésirables).
- Réactions hématologiques :
- De rares cas de pancytopénies et de très rares cas d'aplasies médullaires, dont certains d'évolution fatale, ont été rapportés chez des patients traités par Enbrel. Une attention particulière doit être portée aux patients traités par Enbrel ayant des antécédents d'atteinte hématologique. Tous les patients traités par Enbrel et les parents/entourage doivent être informés qu'en cas d'apparition de signes ou de symptômes évoquant une atteinte hématologique ou une infection (tels que fièvre persistante, douleurs pharyngées, ecchymoses, saignement, pâleur) chez les patients sous Enbrel, ils doivent immédiatement consulter un médecin. Chez ces patients, des examens complémentaires, notamment une numération formule sanguine, doivent être pratiqués en urgence ; si une atteinte hématologique est confirmée, le traitement par Enbrel doit être arrêté.
- Troubles neurologiques :
- De rares cas de troubles de démyélinisation du SNC ont été rapportés chez des patients traités par Enbrel (cf Effets indésirables). De très rares cas de polyneuropathies périphériques démyélinisantes ont également été rapportés (dont le syndrome de Guillain-Barré, la polyneuropathie chronique inflammatoire démyélinisante, la polyneuropathie démyélinisante et la neuropathie motrice multifocale). Bien qu'aucun essai clinique n'ait été réalisé afin d'étudier le traitement par Enbrel chez des patients atteints de sclérose en plaques, des essais réalisés avec d'autres antagonistes du TNF chez des patients atteints de sclérose en plaques ont mis en évidence une majoration de l'activité de la maladie. Il est recommandé d'évaluer attentivement le rapport bénéfice/risque, avec une évaluation neurologique avant de prescrire Enbrel chez des patients ayant des antécédents de maladie démyélinisante ou en cas de survenue récente de maladie démyélinisante, ou chez les patients considérés comme ayant un risque accru de développement d'une maladie démyélinisante.
- Traitement associé :
- Dans un essai clinique contrôlé d'une durée de 2 ans chez des patients adultes atteints de polyarthrite rhumatoïde, l'association d'Enbrel et du méthotrexate n'a pas montré de données de tolérance inattendues, et le profil de tolérance d'Enbrel associé au méthotrexate était similaire aux profils rapportés dans les études avec Enbrel et le méthotrexate utilisés seuls. Des études à long terme évaluant la tolérance de cette association sont actuellement en cours. La tolérance à long terme d'Enbrel en association avec d'autres traitements de fond n'a pas été établie.
- L'utilisation d'Enbrel en association avec d'autres traitements systémiques ou la photothérapie dans le traitement du psoriasis n'a pas été étudiée.
- Insuffisance rénale et hépatique :
- Sur la base de données de pharmacocinétique (cf Pharmacocinétique), aucun ajustement posologique n'est nécessaire chez les patients insuffisants rénaux ou hépatiques ; l'expérience clinique chez de tels patients est limitée.
- Insuffisance cardiaque congestive :
- Les médecins devront utiliser Enbrel avec précaution chez les patients présentant une insuffisance cardiaque congestive (ICC). Ont été rapportés, après commercialisation, des cas d'aggravation d'ICC avec ou sans facteur favorisant identifiable, chez des patients sous Enbrel. Deux importantes études cliniques évaluant Enbrel dans le traitement de l'ICC ont été interrompues précocement du fait d'un manque d'efficacité. Bien que non concluantes, les données d'une de ces études suggèrent une tendance possible vers l'aggravation de l'ICC, chez les patients qui recevaient Enbrel.
- Hépatite alcoolique :
- Dans une étude de phase II randomisée, contrôlée versus placebo, portant sur 48 patients hospitalisés traités par Enbrel ou placebo pour hépatite alcoolique modérée à sévère, Enbrel n'a pas été efficace et le taux de mortalité des patients traités par Enbrel était significativement plus élevé après 6 mois. Par conséquent, Enbrel ne doit pas être utilisé chez les patients présentant une hépatite alcoolique modérée à sévère.
- Granulomatose de Wegener :
- Un essai contrôlé versus placebo, dans lequel 89 patients adultes étaient traités par Enbrel ajouté au traitement standard (incluant du cyclophosphamide ou du méthotrexate, et des glucocorticoïdes) pendant une durée médiane de 25 mois, n'a pas démontré qu'Enbrel est un traitement efficace dans la granulomatose de Wegener. L'incidence des tumeurs malignes non cutanées de différents types a été significativement plus élevée chez les patients traités par Enbrel que dans le groupe contrôle. Enbrel n'est pas recommandé dans le traitement de la granulomatose de Wegener.
- Hypoglycémies chez des patients traités pour un diabète :
- Des cas d'hypoglycémie ont été rapportés suite à l'initiation d'Enbrel chez des patients qui recevaient un traitement antidiabétique. Ces hypoglycémies ont nécessité une diminution du traitement antidiabétique chez certains de ces patients.
- Maladie intestinale inflammatoire (MII) chez des patients atteints d'arthrite juvénile idiopathique (AJI) :
- Des cas de MII ont été rapportés chez des patients atteints d'AJI traités par Enbrel (cf Effets indésirables).
- Alcool benzylique (Enbrel 25 mg/ml pour usage pédiatrique) :
- Enbrel contient de l'alcool benzylique comme excipient, qui peut entraîner des réactions toxiques et des réactions de type anaphylactoïde chez les nourrissons et les enfants jusqu'à 3 ans et ne doit pas être administré chez les prématurés ou les nouveau-nés.
- Populations particulières :
- Patients âgés (>= 65 ans) :
- Au cours des études de phase 3 dans la polyarthrite rhumatoïde, le rhumatisme psoriasique et la spondylarthrite ankylosante, aucune différence globale en termes d'événements indésirables, d'événements indésirables graves et d'infections graves n'a été observée chez les patients âgés de 65 ans ou plus recevant Enbrel comparé à des patients plus jeunes. Cependant, la prudence s'impose en cas de traitement des patients âgés et une attention particulière doit être portée concernant la survenue des infections.
INTERACTIONS |
- Traitement concomitant avec l'anakinra :
- Les patients adultes traités par Enbrel et l'anakinra ont présenté un taux plus élevé d'infections graves par rapport aux patients traités soit par Enbrel seul, soit par l'anakinra seul (données historiques).
- De plus, dans un essai contrôlé, en double aveugle, versus placebo, chez des patients adultes recevant un traitement de fond par le méthotrexate, les patients traités par Enbrel et l'anakinra ont présenté un taux plus élevé d'infections graves (7 %) et de neutropénies que les patients traités par Enbrel seul (cf Mises en garde et Précautions d'emploi, Effets indésirables). L'association d'Enbrel et de l'anakinra n'a pas démontré de bénéfice clinique supérieur et n'est par conséquent pas recommandée.
- Traitement concomitant avec l'abatacept :
- L'administration concomitante de l'abatacept et d'Enbrel au cours d'études cliniques a entraîné une augmentation de l'incidence des événements indésirables graves. Cette association n'a pas démontré de bénéfice clinique supplémentaire ; par conséquent, cette association n'est pas recommandée (cf Mises en garde et Précautions d'emploi).
- Traitement concomitant avec la sulfasalazine :
- Dans une étude clinique chez des patients adultes traités par des doses stables de sulfasalazine et chez lesquels Enbrel était ajouté, les patients du groupe recevant cette association ont présenté une diminution significative du nombre moyen de globules blancs, par rapport aux groupes traités par Enbrel ou la sulfasalazine seuls. La signification clinique de cette interaction est inconnue.
- L'utilisation d'Enbrel en association avec la sulfasalazine ne doit être envisagée qu'avec précaution.
- Absence d'interactions :
- Dans les essais cliniques, aucune interaction n'a été observée lorsque Enbrel était administré avec des glucocorticoïdes, des salicylés (sauf la sulfasalazine), des anti-inflammatoires non stéroïdiens (AINS), des analgésiques ou le méthotrexate. Cf Mises en garde et Précautions d'emploi pour les recommandations sur la vaccination.
- Aucune interaction pharmacocinétique médicamenteuse significative n'a été observée dans les études avec la digoxine et la warfarine.
FERTILITÉ/GROSSESSE/ALLAITEMENT |
Aucune étude avec Enbrel n'a été conduite chez la femme enceinte. Des études de toxicité sur la reproduction réalisées chez le rat et le lapin n'ont pas mis en évidence de dommage pour le foetus ou pour le rat nouveau-né qui serait dû à l'étanercept. Il n'existe pas de données précliniques disponibles sur la toxicité péri et postnatale de l'étanercept, ni sur les effets de l'étanercept sur la fertilité et la fonction reproductrice générale. Ainsi, l'utilisation d'Enbrel chez la femme enceinte n'est pas recommandée et les femmes en âge de procréer doivent être averties qu'il faut éviter une grossesse pendant le traitement par Enbrel.
Allaitement :
On ne sait pas si l'étanercept est excrété dans le lait maternel. Après administration sous-cutanée chez les rates allaitantes, l'étanercept a été excrété dans le lait et détecté dans le sérum des nouveau-nés. Du fait que les immunoglobulines, comme de nombreux médicaments, peuvent être excrétées dans le lait maternel, il doit être envisagé soit d'interrompre l'allaitement soit de suspendre Enbrel pendant l'allaitement.
CONDUITE et UTILISATION DE MACHINES |
EFFETS INDÉSIRABLES |
- Résumé du profil de tolérance :
- Les effets indésirables le plus fréquemment rapportés sont les réactions au site d'injection (telles que douleur, gonflement, démangeaison, rougeur et saignement au site d'injection), les infections (telles que les infections respiratoires hautes, les bronchites, les cystites et les infections cutanées), les réactions allergiques, le développement d'auto-anticorps, les démangeaisons et la fièvre.
- Des effets indésirables graves ont aussi été rapportés avec Enbrel. Les antagonistes du TNF, comme Enbrel, affectent le système immunitaire et leur utilisation peut affecter les défenses de l'organisme contre l'infection et le cancer. Les infections graves touchent moins de 1 patient sur 100 traités par Enbrel. Les cas rapportés incluaient des infections fatales, des infections mettant en jeu le pronostic vital et des septicémies. Diverses tumeurs malignes ont aussi été rapportées avec l'utilisation d'Enbrel, incluant des cancers du sein, du poumon, de la peau et des ganglions lymphatiques (lymphome).
- Des effets indésirables hématologiques, neurologiques et auto-immuns graves ont également été rapportés. Ceux-ci incluaient de rares cas de pancytopénie et de très rares cas d'aplasie médullaire. Des épisodes de démyélinisation, centrale et périphérique, ont été observés, respectivement rarement et très rarement, au cours de l'utilisation d'Enbrel. De cas rares de lupus, de syndrome lupique et de vascularite ont été observés.
- La liste ci-dessous des effets indésirables est issue de l'expérience des essais cliniques chez l'adulte et des données rapportées depuis la mise sur le marché.
- Selon le système de classification par organe, les effets indésirables sont listés ci-dessous par ordre de fréquence (nombre de patients susceptibles de présenter un effet donné), en utilisant les catégories suivantes : très fréquent (>= 1/10) ; fréquent (>= 1/100 à < 1/10) ; peu fréquent (>= 1/1000 à < 1/100) ; rare (>= 1/10 000 à < 1/1000) ; très rare (< 1/10 000) ; fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
- Infections et infestations :
- Très fréquent : Infections (y compris infections des voies respiratoires supérieures, bronchites, cystites, infections cutanées)*.
- Peu fréquent : Infections graves (y compris pneumonies, cellulite, arthrites septiques, septicémies)*.
- Rare : Tuberculose, infections opportunistes (incluant infections fongiques invasives, à protozoaires, bactériennes et mycobactériennes atypiques)*.
- Très fréquent : Infections (y compris infections des voies respiratoires supérieures, bronchites, cystites, infections cutanées)*.
- Tumeurs bénignes, malignes et non précisées (incluant kystes et polypes) :
- Peu fréquent : Cancer cutané non mélanomateux* (cf Mises en garde et Précautions d'emploi).
- Rare : Lymphome, mélanome (cf Mises en garde et Précautions d'emploi).
- Fréquence indéterminée : Leucémie, carcinome à cellules de Merkel (cf Mises en garde et Précautions d'emploi).
- Peu fréquent : Cancer cutané non mélanomateux* (cf Mises en garde et Précautions d'emploi).
- Affections hématologiques et du système lymphatique :
- Peu fréquent : Thrombocytopénie.
- Rare : Anémie, leucopénie, neutropénie, pancytopénie*.
- Très rare : Aplasie médullaire*.
- Peu fréquent : Thrombocytopénie.
- Affections du système immunitaire :
- Fréquent : Réactions allergiques (cf Affections de la peau et du tissu sous-cutané), formation d'auto-anticorps*.
- Rare : Réactions allergiques/anaphylactiques graves (y compris angioedème, bronchospasme).
- Fréquence indéterminée : Syndrome d'activation macrophagique*, vascularite positive aux anticorps anticytoplasmiques de neutrophiles.
- Fréquent : Réactions allergiques (cf Affections de la peau et du tissu sous-cutané), formation d'auto-anticorps*.
- Affections du système nerveux :
- Rare : convulsions, épisodes de démyélinisation du SNC pouvant évoquer une sclérose en plaques ou un tableau de démyélinisation localisée telle qu'une névrite optique ou une myélite transverse (cf Mises en garde et Précautions d'emploi).
- Très rare : épisodes de démyélinisation périphérique, incluant syndrome de Guillain-Barré, polyneuropathie chronique inflammatoire démyélinisante, polyneuropathie démyélinisante et neuropathie motrice multifocale (cf Mises en garde et Précautions d'emploi)
- Rare : convulsions, épisodes de démyélinisation du SNC pouvant évoquer une sclérose en plaques ou un tableau de démyélinisation localisée telle qu'une névrite optique ou une myélite transverse (cf Mises en garde et Précautions d'emploi).
- Affections oculaires :
- Peu fréquent : uvéites.
- Peu fréquent : uvéites.
- Affections cardiaques :
- Rare : Aggravation de l'insuffisance cardiaque congestive (cf Mises en garde et Précautions d'emploi).
- Rare : Aggravation de l'insuffisance cardiaque congestive (cf Mises en garde et Précautions d'emploi).
- Affections respiratoires, thoraciques et médiastinales :
- Peu fréquent : Maladie interstitielle du poumon (incluant la pneumopathie et la fibrose pulmonaire)*.
- Peu fréquent : Maladie interstitielle du poumon (incluant la pneumopathie et la fibrose pulmonaire)*.
- Affections hépatobiliaires :
- Rare : Élévation des enzymes hépatiques.
- Rare : Élévation des enzymes hépatiques.
- Affections de la peau et du tissu sous-cutané :
- Fréquent : Prurit.
- Peu fréquent : Angioedème, urticaire, éruption cutanée, éruption psoriasiforme, psoriasis, y compris une première atteinte ou aggravation, et atteinte pustuleuse (principalement palmo-plantaire).
- Rare : Vascularite cutanée (incluant la vascularite leucocytoclastique), syndrome de Stevens-Johnson, érythème polymorphe.
- Très rare : Syndrome de Lyell.
- Fréquent : Prurit.
- Affections musculosquelettiques et systémiques :
- Rare : Lupus érythémateux cutané subaigu, lupus érythémateux discoïde, syndrome lupique.
- Rare : Lupus érythémateux cutané subaigu, lupus érythémateux discoïde, syndrome lupique.
- Troubles généraux et anomalies au site d'administration :
- Très fréquent : Réactions au site d'injection (y compris saignement, contusion, érythème, démangeaison, douleur, gonflement)*.
- Fréquent : Fièvre.
- Très fréquent : Réactions au site d'injection (y compris saignement, contusion, érythème, démangeaison, douleur, gonflement)*.
-
*
Cf Informations complémentaires ci-dessous.
- Informations complémentaires :
-
- Tumeurs malignes et troubles lymphoprolifératifs :
- L'apparition de 129 nouvelles tumeurs malignes de différents types a été observée sur un total de 4114 patients atteints de polyarthrite rhumatoïde traités par Enbrel dans des essais cliniques jusqu'à 6 ans environ, incluant 231 patients traités par Enbrel associé au méthotrexate dans l'étude contrôlée versus traitement actif d'une durée de 2 ans. Les taux et incidences observés dans ces essais cliniques étaient similaires à ceux attendus dans la population étudiée. Un total de 2 tumeurs malignes a été rapporté au cours des études cliniques incluant 240 patients atteints de rhumatisme psoriasique traités par Enbrel sur une durée de 2 ans environ. Dans les études cliniques conduites pendant plus de 2 ans chez 351 patients atteints de spondylarthrite ankylosante, 6 tumeurs malignes ont été rapportées chez des patients traités par Enbrel. Dans un groupe de 2711 patients atteints de psoriasis en plaques et traités par Enbrel sur une durée maximale de 2,5 ans dans les études en double aveugle et en ouvert, 30 tumeurs malignes et 43 cancers cutanés non mélanomateux ont été rapportés.
- Dans un groupe de 7416 patients traités par Enbrel au cours des essais cliniques dans la polyarthrite rhumatoïde, le rhumatisme psoriasique, la spondylarthrite ankylosante et le psoriasis, 18 lymphomes ont été rapportés.
- Divers cas de tumeurs malignes (incluant cancer du sein, du poumon, lymphome) ont été également rapportés après commercialisation (cf Mises en garde et Précautions d'emploi).
-
- Réactions au site d'injection :
- L'incidence des réactions au site de l'injection était significativement plus élevée chez les patients atteints d'affections rhumatismales traités par Enbrel comparativement au placebo (36 % vs 9 %). Les réactions au site d'injection sont survenues généralement au cours du premier mois de traitement. Leur durée moyenne était approximativement de 3 à 5 jours. La majorité des réactions au site d'injection dans les groupes traités par Enbrel n'a nécessité aucun traitement. La majorité des patients ayant reçu un traitement ont reçu des préparations topiques telles que des corticostéroïdes ou des antihistaminiques oraux. Par ailleurs, certains patients ont développé des réactions « de rappel » caractérisées par l'apparition d'une réaction cutanée au site d'injection le plus récent accompagnée de réactions cutanées aux sites d'injections précédents. Ces réactions étaient généralement transitoires et ne sont pas réapparues lors de la poursuite du traitement.
- Dans les essais contrôlés chez les patients atteints de psoriasis en plaques, approximativement 13,6 % des patients traités par Enbrel ont développé des réactions au site d'injection comparé à 3,4 % des patients traités par placebo au cours des 12 premières semaines de traitement.
-
- Infections graves :
- Dans les essais contre placebo, aucune augmentation de l'incidence des infections graves (fatales, mettant en jeu le pronostic vital, nécessitant une hospitalisation ou une administration intraveineuse d'antibiotiques) n'a été observée. Des infections graves sont survenues chez 6,3 % des patients atteints de polyarthrite rhumatoïde traités par Enbrel jusqu'à 48 mois. Ces infections incluaient des abcès (diverses localisations), bactériémie, bronchite, bursite, cellulite infectieuse, cholécystite, diarrhée, diverticulite, endocardite (suspectée), gastroentérite, hépatite B, herpès, ulcère de la jambe, infection buccale, ostéomyélite, otite, péritonite, pneumonie, pyélonéphrite, septicémie, arthrite septique, sinusite, infection cutanée, ulcère de la peau, infection urinaire, vascularite et plaie infectée. Dans l'étude contrôlée versus traitement actif d'une durée de 2 ans, dans laquelle les patients étaient traités soit par Enbrel seul, soit par le méthotrexate seul, soit par Enbrel associé au méthotrexate, les taux d'infections graves étaient similaires parmi les groupes de traitement. Cependant, il ne peut être exclu que l'association d'Enbrel au méthotrexate puisse être associée à une augmentation du taux d'infections.
- Il n'y a pas eu de différence dans les taux d'infection parmi les patients traités avec Enbrel et ceux traités avec le placebo pour le psoriasis en plaques dans les essais contre placebo d'une durée allant jusqu'à 24 semaines. Les infections graves rapportées chez les patients traités par Enbrel incluaient : cellulite, gastroentérite, pneumonie, cholécystite, ostéomyélite, gastrite, appendicite, fasciite à streptocoque, myosite, choc septique, diverticulite et abcès. Au cours des essais en double aveugle et en ouvert dans le rhumatisme psoriasique, il a été rapporté un cas d'infection grave (pneumonie).
- Des infections graves ou fatales ont été rapportées lors de l'utilisation d'Enbrel ; les agents pathogènes identifiés sont des bactéries, des mycobactéries (y compris le bacille de la tuberculose), des virus et des champignons. Certaines sont apparues quelques semaines après le début du traitement par Enbrel chez des patients ayant des facteurs prédisposants (par exemple diabète, insuffisance cardiaque, antécédents infectieux ou infection chronique) en plus de leur polyarthrite rhumatoïde (cf Mises en garde et Précautions d'emploi). Un traitement avec Enbrel peut augmenter la mortalité chez les patients atteints de septicémie avérée.
- Des infections opportunistes ont été rapportées en association avec Enbrel, y compris des infections fongiques invasives, à protozoaires, bactériennes (incluant listeria et legionella), et mycobactériennes atypiques. Selon des données combinées des essais cliniques, l'incidence globale des infections opportunistes a été de 0,09 % chez les 15 402 sujets ayant reçu Enbrel. Le taux d'événements rapporté à l'exposition a été de 0,06 événement pour 100 patients-année. Environ la moitié des cas d'infections opportunistes rapportés dans le monde après commercialisation étaient des infections fongiques invasives. Les infections fongiques invasives le plus fréquemment rapportées étaient dues à pneumocystis et aspergillus. Plus de la moitié des décès liés à des infections opportunistes était due à des infections fongiques invasives. La majorité des cas de décès concernait des patients atteints de pneumonie à pneumocystis, d'infection fongique systémique non spécifiée, ou d'aspergillose (cf Mises en garde et Précautions d'emploi).
-
- Auto-anticorps :
- Des analyses sanguines à la recherche d'auto-anticorps ont été réalisées à différents moments chez les patients adultes. Parmi les patients atteints de polyarthrite rhumatoïde pour lesquels le taux d'anticorps antinucléaires a été mesuré (ANA), le pourcentage de patients ayant développé des nouveaux anticorps antinucléaires (>= 1:40) était plus élevé chez les patients traités par Enbrel (11 %) que chez les patients traités par placebo (5 %). Le pourcentage de patients ayant développé des nouveaux anticorps anti-ADN natif était aussi plus élevé par dosage radio-immunologique (15 % des patients traités par Enbrel contre 4 % des patients traités par placebo) et par recherche sur Crithidia lucilliae (3 % des patients traités par Enbrel contre 0 % des patients traités par placebo). La proportion de patients traités par Enbrel ayant développé des anticorps anticardiolipines était augmentée de façon similaire comparativement aux patients traités par placebo. L'impact à long terme d'un traitement par Enbrel sur le développement de maladies auto-immunes est inconnu.
- Ont été rapportés de rares cas de patients (y compris ceux ayant un facteur rhumatoïde positif) ayant développé d'autres auto-anticorps associés à un syndrome lupique ou à des éruptions compatibles sur le plan clinique et, après biopsie, avec un lupus cutané subaigu ou un lupus discoïde.
-
- Pancytopénie et aplasie médullaire :
- Après commercialisation, des cas de pancytopénie et d'aplasie médullaire ont été rapportés, dont certains ont eu une issue fatale (cf Mises en garde et Précautions d'emploi).
-
- Maladie interstitielle du poumon :
- Après commercialisation, des cas de maladie interstitielle du poumon (incluant la pneumopathie et la fibrose pulmonaire) ont été rapportés, dont certains ont eu une issue fatale.
-
- Traitement concomitant avec l'anakinra :
- Dans les études où les patients adultes ont reçu un traitement concomitant par Enbrel et l'anakinra, un taux plus élevé d'infections graves a été observé par rapport à Enbrel seul et 2 % des patients (3/139) ont présenté une neutropénie (polynucléaires neutrophiles < 1000/mm3). Tandis qu'il présentait une neutropénie, un patient a développé une cellulite qui a guéri après hospitalisation (cf Mises en garde et Précautions d'emploi, Interactions).
- Effets indésirables chez l'enfant atteint d'arthrite juvénile idiopathique polyarticulaire (Enbrel seringue préremplie à 25 mg, flacon à 25 mg et flacon à 25 mg/ml pour usage pédiatrique) :
- En général, les événements indésirables chez les enfants atteints d'arthrite juvénile idiopathique ont été similaires en fréquence et en nature à ceux observés chez les adultes (cf supra). Les différences par rapport aux adultes et les autres particularités sont décrites dans les rubriques suivantes.
- Les types d'infections rapportés dans les essais cliniques chez des patients atteints d'arthrite juvénile idiopathique âgés de 2 à 18 ans étaient généralement peu sévères à modérés et similaires aux types d'infections communément observés chez des patients pédiatriques. Les événements indésirables sévères rapportés ont été des varicelles avec des signes et symptômes de méningite aseptique suivie d'une guérison sans séquelle (cf Mises en garde et Précautions d'emploi), appendicite, gastroentérite, dépression/trouble de la personnalité, ulcère cutané, oesophagite/gastrite, choc septique à streptocoque du groupe A, diabète de type I et infection d'une plaie postopératoire et du tissu mou.
- Dans une étude chez des enfants atteints d'arthrite juvénile idiopathique âgés de 4 à 17 ans, 43 des 69 enfants (62 %) ont présenté une infection en recevant Enbrel pendant les 3 mois de l'étude (partie 1 en ouvert) et la fréquence ainsi que la sévérité des infections étaient similaires chez les 58 patients ayant poursuivi l'étude d'extension en ouvert pendant 12 mois. Les types et la proportion de l'ensemble des événements indésirables chez les patients atteints d'arthrite juvénile idiopathique étaient similaires à ceux observés dans les essais cliniques d'Enbrel chez les adultes atteints de polyarthrite rhumatoïde et étaient en majorité d'intensité légère.
- Plusieurs événements indésirables ont été rapportés plus fréquemment chez les 69 patients atteints d'arthrite juvénile idiopathique ayant reçu Enbrel pendant 3 mois en comparaison avec les 349 patients adultes atteints de polyarthrite rhumatoïde. Il s'agissait de céphalées (19 % des patients, 1,7 événement par patient-année), nausées (9 %, 1 événement par patient-année), douleurs abdominales (19 %, 0,74 événement par patient-année) et vomissements (13 %, 0,74 événement par patient-année).
- Quatre cas de syndrome d'activation macrophagique ont été rapportés au cours des essais cliniques dans l'arthrite juvénile idiopathique.
- Depuis la commercialisation, des cas de maladie intestinale inflammatoire ont été rapportés chez des patients atteints d'AJI traités par Enbrel ; un petit nombre de ces cas a récidivé lors de la reprise du traitement par Enbrel (cf Mises en garde et Précautions d'emploi).
- Effets indésirables chez l'enfant atteint de psoriasis en plaques (Enbrel seringues préremplies à 25 mg et à 50 mg, flacon à 25 mg, flacon à 25 mg/ml pour usage pédiatrique et stylo prérempli à 50 mg) :
- Dans une étude sur 48 semaines réalisée chez 211 enfants âgés de 4 à 17 ans et atteints de psoriasis en plaques, les événements indésirables rapportés ont été similaires à ceux observés dans les études antérieures réalisées chez des adultes atteints de psoriasis en plaques.
SURDOSAGE |
Il n'existe aucun antidote connu d'Enbrel.
PHARMACODYNAMIE |
Classe pharmacothérapeutique : Immunosuppresseurs/Inhibiteurs du facteur nécrosant des tumeurs alpha (TNFalpha) ; code ATC : L04AB01.
Le facteur nécrosant des tumeurs (TNF) est une cytokine dominante dans le processus inflammatoire de la polyarthrite rhumatoïde. Des taux élevés de TNF sont également retrouvés dans les membranes synoviales et les plaques de psoriasis des patients atteints de rhumatisme psoriasique, et dans le sérum et le tissu synovial des patients atteints de spondylarthrite ankylosante.
Dans les plaques de psoriasis, l'infiltration par les cellules inflammatoires, y compris les cellules T, conduit à une augmentation des taux de TNF dans les lésions psoriasiques, comparativement aux taux observés au niveau des zones non atteintes de la peau.
L'étanercept est un inhibiteur compétitif de la liaison du TNF à ses récepteurs de surface, inhibant ainsi l'activité biologique du TNF.
Le TNF et la lymphotoxine sont des cytokines pro-inflammatoires qui lient deux récepteurs distincts à la surface des cellules : les récepteurs du facteur nécrosant des tumeurs (TNFR) de 55-kilodaltons (p55) et de 75-kilodaltons (p75). Ces deux TNFR existent naturellement sous des formes membranaires et solubles. On pense que les TNFR solubles régulent l'activité biologique du TNF. Le TNF et la lymphotoxine existent principalement sous forme d'homotrimères, leur activité biologique étant dépendante de la réticulation des TNFR à la surface des cellules. Les récepteurs dimères solubles tels qu'étanercept présentent une affinité plus marquée pour le TNF que les récepteurs monomères et sont des inhibiteurs compétitifs beaucoup plus puissants de la liaison du TNF à ses récepteurs cellulaires. De plus, l'utilisation d'une région Fc d'immunoglobuline en tant qu'élément de fusion dans la construction d'un récepteur dimère confère à la molécule une demi-vie plasmatique plus longue.
- Mécanisme d'action :
- La majorité des atteintes articulaires de la polyarthrite rhumatoïde, de la spondylarthrite ankylosante et des atteintes cutanées du psoriasis en plaques est médiée par des molécules pro-inflammatoires qui appartiennent à un réseau contrôlé par le TNF. Le mécanisme d'action supposé d'étanercept consiste en une inhibition compétitive de la liaison du TNF aux TNFR de la surface cellulaire : les réponses cellulaires médiées par le TNF sont bloquées en rendant le TNF biologiquement inactif. L'étanercept pourrait également moduler les réponses biologiques contrôlées par d'autres molécules agissant en aval (par exemple cytokines, adhésines ou protéinases) dont l'activité est induite ou régulée par le TNF.
- Essais cliniques :
- Cette rubrique présente les données issues de quatre études contrôlées randomisées chez l'adulte atteint de polyarthrite rhumatoïde, d'une étude dans l'arthrite juvénile idiopathique polyarticulaire, d'une étude chez l'adulte atteint de rhumatisme psoriasique, d'une étude chez l'adulte atteint de spondylarthrite ankylosante, d'une étude chez l'enfant atteint de psoriasis en plaques et de quatre études chez l'adulte atteint de psoriasis en plaques.
-
- Patients adultes atteints de polyarthrite rhumatoïde (Enbrel seringues préremplies à 25 mg et 50 mg, flacon à 25 mg, flacon à 25 mg/ml pour usage pédiatrique et stylo prérempli à 50 mg) :
- L'efficacité d'Enbrel a été évaluée dans une étude randomisée, en double aveugle, contrôlée versus placebo. L'étude a évalué 234 patients adultes, ayant une polyarthrite rhumatoïde active, ne répondant pas à au moins un, et au plus quatre traitements de fond. Des doses de 10 mg ou 25 mg d'Enbrel ou du placebo ont été administrées par voie sous-cutanée deux fois par semaine pendant 6 mois consécutifs. Les résultats de cette étude contrôlée ont été exprimés en pourcentage d'amélioration de la polyarthrite rhumatoïde, en utilisant les critères de réponse de l'American College of Rheumatology (ACR).
- Les réponses ACR 20 et ACR 50 étaient supérieures chez les patients traités par Enbrel par rapport au placebo à 3 et 6 mois (ACR 20 : Enbrel 62 % et 59 %, placebo 23 % et 11 % respectivement à 3 et 6 mois ; ACR 50 : Enbrel 41 % et 40 %, placebo 8 % et 5 % respectivement à 3 et 6 mois ; p < 0,01 Enbrel vs placebo à tous les temps de mesure pour les réponses ACR 20 et ACR 50).
- Environ 15 % des patients recevant Enbrel ont obtenu une réponse ACR 70 à 3 mois et à 6 mois, comparativement à moins de 5 % des patients sous placebo. Parmi les patients recevant Enbrel, les réponses cliniques ont généralement débuté 1 à 2 semaines après l'initiation du traitement, et ont été quasiment toujours obtenues dans les 3 mois. Une réponse dose-dépendante a été observée ; les résultats avec 10 mg étaient intermédiaires entre le placebo et 25 mg. Enbrel était significativement supérieur au placebo sur tous les items des critères ACR, ainsi que sur les autres mesures d'activité de la polyarthrite rhumatoïde non compris dans ces critères de réponse ACR, comme la durée de la raideur matinale. L'échelle HAQ (Health Assessment Questionnaire), incluant le handicap, l'activité, l'état mental, l'état général, l'état des fonctions articulaires, a été évaluée tous les 3 mois pendant l'étude. Tous les domaines de l'échelle HAQ ont été améliorés chez les patients traités par Enbrel comparés aux patients sous placebo à 3 et 6 mois.
- Après l'arrêt d'Enbrel, les symptômes d'arthrite sont généralement réapparus au cours du mois suivant. Selon les résultats des études en ouvert, la reprise du traitement par Enbrel après des arrêts allant jusqu'à 24 mois a entraîné la même amplitude de réponse que chez les patients recevant Enbrel sans interruption de traitement. Des réponses stables et durables ont été observées chez des patients recevant Enbrel sans interruption jusqu'à 48 mois dans les études en ouvert (phase d'extension des études thérapeutiques) ; une expérience à plus long terme n'est pas disponible.
- L'efficacité d'Enbrel a été comparée avec le méthotrexate dans une étude randomisée, contrôlée contre traitement actif avec des examens radiographiques réalisés en aveugle comme critère principal d'évaluation, chez 632 patients adultes ayant une polyarthrite rhumatoïde active (de durée < 3 ans) qui n'avaient jamais reçu de traitement par méthotrexate. Des doses de 10 mg ou de 25 mg d'Enbrel ont été administrées par voie sous-cutanée deux fois par semaine jusqu'à 24 mois. Les doses de méthotrexate ont été augmentées de 7,5 mg/semaine à 20 mg/semaine maximum au cours des 8 premières semaines de l'essai et maintenues jusqu'à 24 mois. Avec Enbrel à 25 mg, l'amélioration clinique, y compris le délai d'action sous deux semaines, a été similaire à celle observée lors des essais précédents, et s'est maintenue jusqu'à 24 mois. A l'inclusion, les patients avaient un degré d'invalidité modéré, avec des scores moyens de HAQ de 1,4 à 1,5. Le traitement par Enbrel à 25 mg a entraîné une amélioration importante à 12 mois, avec environ 44 % de patients obtenant un score de HAQ normal (moins de 0,5). Ce bénéfice a été maintenu la deuxième année de cette étude.
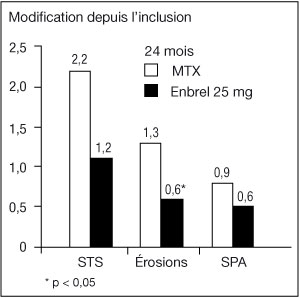
- Dans cette étude, les dommages structuraux articulaires ont été évalués radiographiquement et exprimés en modification du Score Total de Sharp (STS) et de ses composants ; le score d'érosion et le score de pincement articulaire (SPA). Les radiographies des mains/poignets et pieds ont été lues à l'inclusion puis à 6, 12 et 24 mois. La dose de 10 mg d'Enbrel a eu constamment moins d'effet sur les dommages structuraux que la dose de 25 mg. Enbrel à 25 mg a été significativement supérieur au méthotrexate pour les scores d'érosion, à la fois à 12 et 24 mois. Les différences entre le groupe méthotrexate et le groupe Enbrel à 25 mg pour le STS et le SPA n'étaient pas statistiquement significatives. Les résultats sont présentés dans la figure ci-dessous.
-
Progression radiographique : comparaison d'Enbrel vs méthotrexate chez des patients ayant une polyarthrite rhumatoïde d'ancienneté inférieure à 3 ans : 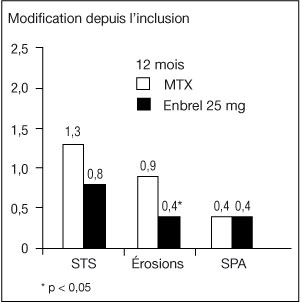
-
- Dans une autre étude contrôlée versus traitement actif, randomisée, en double aveugle, l'efficacité clinique, la tolérance, et l'évolution radiographique chez des patients atteints de PR traités par Enbrel seul (25 mg deux fois par semaine), ou méthotrexate seul (7,5 à 20 mg par semaine, dose médiane : 20 mg) ou Enbrel associé au méthotrexate débutés simultanément, ont été comparées chez 682 patients adultes ayant une polyarthrite rhumatoïde active d'ancienneté de 6 mois à 20 ans (médiane : 5 ans) et qui avaient eu une réponse insuffisante à au moins un traitement de fond autre que le méthotrexate.
- Les patients traités par Enbrel associé au méthotrexate avaient des réponses ACR 20, ACR 50 et ACR 70 ainsi qu'une amélioration des scores DAS et HAQ significativement plus élevées à la fois à 24 et 52 semaines, comparativement aux patients de chacun des groupes en monothérapie (résultats présentés dans le tableau ci-dessous). Des avantages significatifs avec Enbrel associé au méthotrexate comparé à Enbrel en monothérapie et au méthotrexate en monothérapie ont aussi été observés après 24 mois.
-
Résultats d'efficacité clinique à 12 mois : comparaison d'Enbrel vs méthotrexate vs Enbrel associé au méthotrexate chez des patients ayant une PR d'ancienneté de 6 mois à 20 ans Critère Méthotrexate Enbrel Enbrel + méthotrexate (n = 228) (n = 223) (n = 231) Réponses ACR(a) ACR 20 58,8 % 65,5 % 74,5 %(d) ACR 50 36,4 % 43,0 % 63,2 %(d) ACR 70 16,7 % 22,0 % 39,8 %(d) DAS Score à l'inclusion(b) 5,5 5,7 5,5 Score semaine 52(b) 3,0 3,0 2,3(d) Rémission(c) 14 % 18 % 37 %(d) HAQ Inclusion 1,7 1,7 1,8 Semaine 52 1,1 1,0 0,8(d) -
(a)
Les patients qui n'avaient pas terminé les 12 mois de l'étude ont été considérés comme non répondeurs.
-
(b)
Les valeurs du Disease Activity Score (DAS) sont des moyennes.
-
(c)
La rémission est définie par un DAS < 1,6.
-
(d)
Valeur de p, lors des comparaisons deux à deux : p < 0,05 pour les comparaisons des groupes Enbrel + méthotrexate vs méthotrexate et pour les comparaisons des groupes Enbrel + méthotrexate vs Enbrel.
- L'évolution radiographique à 12 mois était significativement moins importante dans le groupe Enbrel que dans le groupe méthotrexate, alors que l'association était significativement meilleure que chacune des monothérapies pour ralentir l'évolution radiographique (voir figure ci-dessous).
-
Évolution radiographique : comparaison d'Enbrel vs méthotrexate vs Enbrel associé au méthotrexate chez des patients ayant une PR d'ancienneté de 6 mois à 20 ans (résultats à 12 mois) : 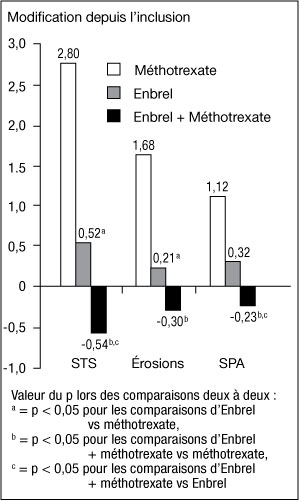
- Des avantages significatifs avec Enbrel associé au méthotrexate comparativement à Enbrel en monothérapie et au méthotrexate en monothérapie ont aussi été observés après 24 mois. De même, des avantages significatifs avec Enbrel en monothérapie comparativement au méthotrexate en monothérapie ont aussi été observés après 24 mois.
- Dans une analyse où tous les patients sortis prématurément de l'étude quelle qu'en soit la raison étaient considérés comme s'étant aggravés, le pourcentage de patients sans aggravation (variation du STS <= 0,5) à 24 mois était plus élevé dans le groupe Enbrel associé au méthotrexate, comparativement à Enbrel seul et au méthotrexate seul (respectivement 62 %, 50 % et 36 % ; p < 0,05). La différence entre Enbrel seul et méthotrexate seul a aussi été significative (p < 0,05). Parmi les patients ayant terminé la totalité des 24 mois de traitement dans l'étude, les taux de patients sans aggravation étaient respectivement de 78 %, 70 % et 61 %.
- La tolérance et l'efficacité d'Enbrel à la dose de 50 mg (deux injections de 25 mg en sous-cutanée), administrée une fois par semaine, ont été évaluées dans une étude en double aveugle, contrôlée versus placebo chez 420 patients atteints de PR active. Dans cette étude, 53 patients ont reçu du placebo, 214 patients ont reçu 50 mg d'Enbrel une fois par semaine et 153 patients ont reçu 25 mg d'Enbrel deux fois par semaine. Les profils d'efficacité et de tolérance des deux schémas posologiques d'Enbrel ont été similaires à la 8e semaine sur les signes et symptômes de la PR. A la 16e semaine, la non-infériorité entre les deux schémas posologiques n'a pas été démontrée. Il a été démontré qu'une injection unique d'étanercept 50 mg/ml était bioéquivalente à deux injections simultanées de 25 mg/ml.
-
- Patients adultes atteints de rhumatisme psoriasique (Enbrel seringues préremplies à 25 mg et 50 mg, flacon à 25 mg et stylo prérempli à 50 mg) :
- L'efficacité d'Enbrel a été évaluée au cours d'une étude clinique randomisée, en double aveugle, contrôlé versus placebo, chez 205 patients atteints de rhumatisme psoriasique. Les patients étaient âgés de 18 à 70 ans et souffraient d'un rhumatisme psoriasique actif (>= 3 articulations gonflées et >= 3 articulations douloureuses) dans au moins l'une de ces formes :
- atteinte interphalangienne distale (AID),
- polyarthrite (absence de nodules rhumatoïdes et présence de psoriasis),
- arthropathie destructrice,
- rhumatisme psoriasique asymétrique,
ou
- ankylose vertébrale de type inflammatoire.
- atteinte interphalangienne distale (AID),
- Les patients avaient également des plaques de psoriasis constituant une lésion dont le diamètre devait être >= 2 cm. Les patients étaient préalablement traités avec des AINS (86 %), des traitements de fond (80 %), et des corticoïdes (24 %). Les patients habituellement traités par méthotrexate MTX (stables depuis >= 2 mois) pouvaient continuer le méthotrexate à une dose constante <= 25 mg/semaine. Des doses de 25 mg d'Enbrel (basées sur les études de recherche de dose chez les patients atteints de polyarthrite rhumatoïde) ou de placebo étaient administrées par voie SC deux fois par semaine pendant 6 mois. A la fin de l'étude en double aveugle, les patients pouvaient entrer dans une étude d'extension en ouvert au long cours pour une durée totale allant jusqu'à 2 ans.
- Les réponses cliniques ont été exprimées en pourcentage de patients atteignant une réponse ACR 20, 50 et 70 et en pourcentages d'amélioration du critère de réponse du rhumatisme psoriasique (PsARC). Les résultats sont résumés dans le tableau ci-après.
-
Réponses des patients atteints de rhumatisme psoriasique dans l'essai contrôlé contre placebo : Réponse du rhumatisme psoriasique Placebo
(n = 104)
%Enbrel(a)
(n = 101)
%ACR 20 Mois 3 15 59(b) Mois 6 13 50(b) ACR 50 Mois 3 4 38(b) Mois 6 4 37(b) ACR 70 Mois 3 0 11(b) Mois 6 1 9(c) PsARC Mois 3 31 72(b) Mois 6 23 70(b) -
(a)
Enbrel 25 mg SC deux fois par semaine.
-
(b)
p < 0,001, Enbrel vs placebo.
-
(c)
p < 0,01, Enbrel vs placebo.
- Parmi les patients atteints de rhumatisme psoriasique ayant reçu Enbrel, les réponses cliniques étaient visibles dès la première évaluation (à 4 semaines) et se maintenaient pendant les 6 mois de traitement. Enbrel a été significativement meilleur que le placebo sur tous les paramètres évaluant l'activité de la maladie (p < 0,001) et les réponses étaient similaires avec et sans traitement concomitant par le méthotrexate. La qualité de vie des patients atteints de rhumatisme psoriasique a été évaluée à plusieurs moments à l'aide de l'indice de handicap du questionnaire HAQ. L'indice de handicap était significativement amélioré à tous les temps d'évaluation chez les patients atteints de rhumatisme psoriasique traités par Enbrel par rapport au groupe placebo (p < 0,001).
- Les modifications radiographiques ont été évaluées dans l'étude sur le rhumatisme psoriasique. Des radiographies des mains et des poignets ont été réalisées à l'inclusion et à 6, 12 et 24 mois. Le STS modifié à 12 mois est présenté dans le tableau ci-dessous.
- Dans une analyse où tous les patients sortis de l'étude, quelle qu'en soit la raison, étaient considérés comme s'étant aggravés, le pourcentage de patients sans aggravation (variation du STS <= 0,5) à 12 mois était plus élevé dans le groupe Enbrel comparativement au groupe placebo (respectivement 73 % vs 47 %, p <= 0,001). L'effet d'Enbrel sur l'aggravation radiographique était maintenu chez les patients qui continuaient le traitement au cours de la deuxième année. Le ralentissement des dommages structuraux articulaires périphériques était observé chez des patients ayant une atteinte polyarticulaire symétrique.
-
Évolution moyenne annualisée (ES) du score total de Sharp depuis l'inclusion : Temps Placebo (n = 104) Étanercept (n = 101) Mois 12 1,00 (0,29) - 0,03 (0,09)(a) - ES = erreur standard à la moyenne.
-
(a)
p = 0,0001.
- Les capacités fonctionnelles ont été améliorées avec le traitement par Enbrel pendant la période en double aveugle, et ce bénéfice a été maintenu au cours de l'exposition à long terme jusqu'à 2 ans.
- Dans la forme axiale du rhumatisme psoriasique, proche de la spondylarthrite ankylosante, et dans la forme mutilante, les preuves d'efficacité d'Enbrel sont insuffisantes en raison du nombre trop faible de patients étudiés.
- Aucune étude n'a été effectuée chez des patients atteints de rhumatisme psoriasique avec le schéma posologique de 50 mg une fois par semaine. Les preuves de l'efficacité du schéma posologique d'une fois par semaine dans cette population de patients reposent sur des données provenant d'une étude chez des patients atteints de spondylarthrite ankylosante.
-
- Patients adultes atteints de spondylarthrite ankylosante (Enbrel seringues préremplies à 25 mg et 50 mg, flacon à 25 mg et stylo prérempli à 50 mg) :
- L'efficacité d'Enbrel dans la spondylarthrite ankylosante a été évaluée dans 3 études, randomisées, en double aveugle, qui ont comparé l'administration à deux fois par semaine d'Enbrel 25 mg versus placebo. Un total de 401 patients a été inclus, dont 203 étaient traités par Enbrel. La plus importante de ces études (n = 277) a inclus des patients âgés de 18 à 70 ans et qui avaient une spondylarthrite ankylosante active définie par des scores d'échelle visuelle analogique (VAS) >= 30 pour la durée et l'intensité moyennes de la raideur matinale, associée à des scores VAS >= 30 pour au moins 2 des 3 paramètres suivants : évaluation globale par le patient ; moyenne des valeurs VAS pour la douleur dorsale nocturne et la douleur dorsale totale ; moyenne des 10 questions de l'Indice Fonctionnel de la Spondylarthrite Ankylosante de Bath (BASFI). Les patients recevant des traitements de fond, des AINS ou des corticoïdes pouvaient continuer ces traitements à des doses constantes. Les patients présentant une ankylose complète de la colonne vertébrale n'ont pas été inclus dans l'étude. Des doses de 25 mg d'Enbrel (déterminées lors des études de recherche de dose chez les patients atteints de polyarthrite rhumatoïde) ou de placebo ont été administrées par voie sous-cutanée deux fois par semaine pendant 6 mois chez 138 patients.
- Le critère principal d'efficacité (ASAS 20) consistait en une amélioration >= 20 % d'au moins 3 des 4 domaines du critère ASAS (Assessment in Ankylosing Spondylitis : évaluations globales par le patient, douleur dorsale, BASFI, et inflammation) et à l'absence d'aggravation du domaine restant.
- Les réponses ASAS 50 et ASAS 70 consistaient en des améliorations respectives de 50 % et 70 % sur les mêmes critères.
- Comparativement au placebo, le traitement avec Enbrel a montré des améliorations significatives des réponses ASAS 20, ASAS 50 et ASAS 70 dès la deuxième semaine après l'initiation du traitement.
-
Réponses des patients atteints de spondylarthrite ankylosante dans un essai contrôlé contre placebo : Réponse de la spondylarthrite ankylosante Placebo
(n = 139)
%Enbrel
(n = 138)
%ASAS 20 2 semaines 22 46(a) 3 mois 27 60(a) 6 mois 23 58(a) ASAS 50 2 semaines 7 24(a) 3 mois 13 45(a) 6 mois 10 42(a) ASAS 70 2 semaines 2 12(b) 3 mois 7 29(b) 6 mois 5 28(b) -
(a)
p < 0,001, Enbrel vs placebo.
-
(b)
p = 0,002, Enbrel vs placebo.
- Parmi les patients atteints de spondylarthrite ankylosante ayant reçu Enbrel, les réponses cliniques sont apparues dès la première visite (2 semaines) et se sont maintenues au cours des 6 mois de traitement.
- Les réponses étaient similaires chez les patients qui initialement recevaient ou non des traitements concomitants.
- Des résultats similaires ont été obtenus au cours des deux essais d'effectifs moins importants réalisés dans la spondylarthrite ankylosante.
- Dans une quatrième étude, la tolérance et l'efficacité d'Enbrel 50 mg (deux injections sous-cutanées de 25 mg) administré une fois par semaine versus Enbrel 25 mg administré deux fois par semaine ont été évaluées dans une étude en double aveugle, contrôlée versus placebo chez 356 patients atteints de spondylarthrite ankylosante active. Les profils de tolérance et d'efficacité des schémas posologiques de 50 mg une fois par semaine et de 25 mg deux fois par semaine ont été similaires.
-
- Patients adultes atteints de psoriasis en plaques (Enbrel seringues préremplies à 25 mg et 50 mg, flacon à 25 mg, flacon à 25 mg/ml pour usage pédiatrique et stylo prérempli à 50 mg) :
- L'utilisation d'Enbrel est recommandée chez les patients définis à la rubrique Indications. Les patients « en échec » dans la population cible sont définis comme présentant une réponse insuffisante (PASI < 50 ou PGA insatisfaisant), ou une aggravation de la maladie au cours du traitement avec au moins chacun des trois traitements systémiques majeurs disponibles utilisés à une posologie adéquate pendant une durée suffisamment longue pour évaluer la réponse au traitement.
- L'efficacité d'Enbrel versus les autres traitements systémiques chez les patients avec un psoriasis modéré à sévère (répondeurs aux autres traitements systémiques) n'a pas été évaluée dans des études comparant directement Enbrel aux autres traitements systémiques. A la place, l'efficacité et la tolérance d'Enbrel ont été évaluées dans quatre études randomisées, contrôlées en double aveugle contre placebo. Le critère primaire d'efficacité dans les quatre études était la proportion de patients dans chaque groupe de traitement qui atteignait le PASI 75 (c'est-à-dire une amélioration par rapport à l'inclusion d'au moins 75 % du score Psoriasis Area and Severity Index) à 12 semaines.
- L'étude 1 était une étude de phase II chez des patients âgés d'au moins 18 ans et présentant un psoriasis en plaques actif mais cliniquement stable, atteignant au moins 10 % de la surface corporelle. 112 patients ont été randomisés pour recevoir une dose de 25 mg d'Enbrel (n = 57) ou du placebo (n = 55) deux fois par semaine pendant 24 semaines.
- L'étude 2 a évalué 652 patients atteints de psoriasis chronique en plaques avec les mêmes critères d'inclusion que dans l'étude 1 et un PASI >= 10 au moment du screening. Enbrel a été administré à des doses de 25 mg une fois par semaine, 25 mg deux fois par semaine ou 50 mg deux fois par semaine pendant 6 mois consécutifs. Au cours des 12 premières semaines de la période de traitement en double aveugle, les patients ont reçu du placebo ou l'une des trois doses d'Enbrel décrites ci-dessus. Après 12 semaines de traitement, les patients du groupe placebo ont commencé le traitement en aveugle par Enbrel (25 mg deux fois par semaine) ; les patients dans les groupes de traitement actif ont continué jusqu'à la semaine 24, à la dose à laquelle ils avaient été initialement randomisés.
- L'étude 3 a évalué 583 patients et les critères d'inclusion étaient les mêmes que dans l'étude 2. Dans cette étude, les patients ont reçu une dose de 25 mg ou 50 mg d'Enbrel, ou du placebo, deux fois par semaine pendant 12 semaines ; puis tous les patients ont reçu 25 mg d'Enbrel deux fois par semaine en ouvert pendant 24 semaines supplémentaires.
- L'étude 4 a évalué 142 patients et les critères d'inclusion étaient similaires à ceux des études 2 et 3. Dans cette étude, les patients ont reçu une dose de 50 mg d'Enbrel ou du placebo une fois par semaine pendant 12 semaines ; puis tous les patients ont reçu 50 mg d'Enbrel une fois par semaine en ouvert pendant 12 semaines supplémentaires.
- Dans l'étude 1, le groupe traité par Enbrel avait une proportion significativement plus élevée de patients présentant une réponse PASI 75 à la semaine 12 (30 %) comparativement au groupe traité par placebo (2 % ; p < 0,0001). A 24 semaines, 56 % des patients dans le groupe traité par Enbrel avaient atteint le PASI 75 comparativement à 5 % des patients traités par placebo. Les résultats principaux des études 2, 3 et 4 sont présentés ci-dessous.
-
Réponses des patients atteints de psoriasis dans les études 2, 3 et 4 : Réponse
(%)Étude 2 Placebo Enbrel 25 mg 2 fois/semaine 50 mg 2 fois/semaine n = 166 n = 162 n = 164 sem 12 sem 12 sem 24(a) sem 12 sem 24(a) PASI 50 14 58* 70 74* 77 PASI 75 4 34* 44 49* 59 DSGA(b) 5 34* 39 49* 55 -
Réponse
(%)Étude 3 Placebo Enbrel 25 mg 2 fois/semaine 50 mg 2 fois/semaine n = 193 n = 196 semaine 12 PASI 50 9 64* 77* PASI 75 3 34* 49* DSGA(b) 4 39* 57* -
Réponse
(%)Étude 4 Placebo Enbrel 50 mg 1 fois/semaine 50 mg 1 fois/semaine n = 46 n = 96 n = 90 sem 12 sem 12 sem 24(a) PASI 50 9 69* 83 PASI 75 2 38* 71 DSGA(b) 4 39* 64 -
*
p <= 0,0001 comparé au placebo.
-
(a)
Aucune comparaison statistique versus placebo n'a été faite à la semaine 24 dans les études 2 et 4 étant donné que le groupe initialement sous placebo a commencé à recevoir Enbrel 25 mg deux fois/semaine ou 50 mg une fois/semaine à partir de la semaine 13 jusqu'à la semaine 24.
-
(b)
Dermatologist Static Global Assessment. Pas de lésions apparentes ou presque pas de lésions apparentes (défini par 0 ou 1 sur une échelle de 0 à 5).
- Parmi les patients atteints de psoriasis en plaques qui recevaient Enbrel, des réponses significatives comparativement au placebo sont apparues à la première visite (2 semaines) et ont été maintenues durant les 24 semaines de traitement.
- L'étude 2 comprenait également une période d'arrêt du traitement au cours de laquelle les patients qui avaient atteint une amélioration du PASI d'au moins 50 % à la semaine 24 arrêtaient le traitement.
- L'apparition d'un rebond (PASI >= 150 % de la valeur à l'inclusion) et le délai de rechute (définie par la perte d'au moins la moitié de l'amélioration obtenue entre l'inclusion et la semaine 24) ont été évalués chez les patients qui n'étaient plus sous traitement. Au cours de la période sans traitement, les symptômes du psoriasis sont progressivement réapparus avec un délai médian de rechute de 3 mois. Aucun effet rebond de la maladie et aucun événement indésirable grave lié au psoriasis n'ont été observés. Il existe des données montrant le bénéfice de la reprise du traitement par Enbrel chez les patients qui répondaient initialement au traitement.
- Dans l'étude 3, la majorité des patients (77 %) qui étaient initialement randomisés à la dose de 50 mg deux fois par semaine et avaient leur dose d'Enbrel abaissée à 25 mg deux fois par semaine à la semaine 12, ont eu une réponse PASI 75 maintenue jusqu'à la semaine 36. Pour les patients qui recevaient 25 mg deux fois par semaine tout au long de l'étude, la réponse PASI 75 continuait de s'améliorer entre les semaines 12 et 36.
- Dans l'étude 4, le groupe traité par Enbrel avait une proportion plus élevée de patients avec une réponse PASI 75 à la semaine 12 (38 %) comparativement au groupe traité par placebo (2 %) [p < 0,0001]. Pour les patients qui recevaient 50 mg une fois par semaine tout au long de l'étude, les réponses d'efficacité ont continué à s'améliorer avec un PASI 75 à la semaine 24 atteignant 71 %.
- Dans les études à long terme (jusqu'à 34 mois) et en ouvert au cours desquelles Enbrel a été administré sans interruption, les réponses cliniques était maintenues et la sécurité était comparable aux études à court terme.
- Une analyse des données cliniques n'a révélé aucune caractéristique de la maladie à l'inclusion qui pourrait conduire les cliniciens à sélectionner le type de posologie le plus approprié (intermittent ou continu). En conséquence, le choix d'un traitement intermittent ou continu doit être basé sur le jugement du médecin et les besoins individuels des patients.
-
- Enfants atteints de psoriasis en plaques (Enbrel seringues préremplies à 25 mg et à 50 mg, flacon à 25 mg, flacon à 25 mg/ml pour usage pédiatrique et stylo prérempli à 50 mg) :
- L'efficacité d'Enbrel a été évaluée dans une étude contrôlée, randomisée, en double aveugle, versus placebo réalisée chez 211 enfants âgés de 4 à 17 ans atteints de psoriasis en plaque modéré à sévère (défini par un score PGA >= 3, une surface cutanée atteinte >= 10 %, et un PASI >= 12). Les patients inclus avaient déjà reçu un traitement par photothérapie ou un traitement systémique, ou étaient mal contrôlés par un traitement topique.
- Les patients recevaient soit Enbrel 0,8 mg/kg (jusqu'à 50 mg) soit le placebo une fois par semaine pendant 12 semaines. A 12 semaines, davantage de patients étaient répondeurs (exemple : PASI 75) dans le groupe Enbrel comparativement au groupe placebo.
-
Résultats à 12 semaines chez les enfants atteints de psoriasis en plaques : Enbrel 0,8 mg/kg 1 fois/semaine Placebo n = 106 n = 105 PASI 75, n (%) 60 (57 %)* 12 (11 %) PASI 50, n (%) 79 (75 %)* 24 (23 %) PGA « blanchi » ou « quasi blanchi », n (%) 56 (53 %)* 14 (13 %) - PGA : évaluation globale par le médecin
-
*
p < 0,0001 comparé au placebo.
- Après la période de traitement en double aveugle de 12 semaines, tous les patients recevaient Enbrel 0,8 mg/kg (jusqu'à 50 mg) une fois par semaine pendant 24 semaines supplémentaires. Les réponses observées pendant la période en ouvert étaient similaires à celles observées pendant la période en double aveugle.
- Pendant une période randomisée d'arrêt, un nombre significativement plus élevé de patients re-randomisés dans le groupe placebo a présenté une rechute (perte de la réponse au PASI 75) en comparaison aux patients re-randomisés dans le groupe Enbrel. En traitement continu, les réponses étaient maintenues jusqu'à 48 semaines.
-
- Enfants atteints d'arthrite juvénile idiopathique polyarticulaire (Enbrel seringue préremplie à 25 mg, flacon à 25 mg et flacon à 25 mg/ml pour usage pédiatrique) :
- La tolérance et l'efficacité d'Enbrel ont été évaluées dans une étude en 2 phases, de 69 enfants ayant une arthrite juvénile idiopathique polyarticulaire avec différentes formes de début de la maladie. Les patients inclus dans l'étude étaient âgés de 4 à 17 ans avec une arthrite juvénile idiopathique polyarticulaire d'intensité modérée à sévère, réfractaires ou intolérants au méthotrexate. Une dose stable d'un seul anti-inflammatoire non stéroïdien et/ou de prednisone (< 0,2 mg/kg/jour ou 10 mg maximum) a été maintenue chez les patients. Dans la première phase de l'étude, tous les patients ont reçu 0,4 mg/kg (maximum 25 mg par injection) d'Enbrel administré en sous-cutané deux fois par semaine. Dans la deuxième phase, les patients avec une réponse clinique à 90 jours ont été randomisés pour soit rester sous Enbrel, soit recevoir un placebo pendant 4 mois avec évaluation de la rechute clinique. Les réponses ont été mesurées en utilisant la définition d'amélioration de l'AJIP, définie par une amélioration >= 30 % d'au moins 3 des 6 critères et une aggravation >= 30 % d'au plus 1 des 6 critères, incluant le nombre d'articulations atteintes, la limitation des mouvements, les évaluations globales par le médecin et par le patient/parent, le handicap fonctionnel et la vitesse de sédimentation (VS). La rechute clinique était définie comme une aggravation >= 30 % de 3 des 6 critères et une amélioration >= 30 % d'au plus 1 des 6 critères ainsi qu'un minimum de 2 articulations atteintes.
- Dans la première phase de l'étude, 51 des 69 patients (74 %) ont bénéficié d'une réponse clinique et ont été inclus dans la deuxième phase de l'étude. Dans la deuxième phase de l'étude, 6 des 25 patients (24 %) maintenus sous Enbrel ont eu une rechute clinique en comparaison avec 20 sur 26 patients (77 %) sous placebo (p = 0,007). A partir du début de la deuxième phase de l'étude, la médiane du délai de rechute clinique a été supérieure ou égale à 116 jours pour les patients ayant reçu Enbrel et 28 jours pour les patients sous placebo. Parmi les patients qui ont bénéficié d'une réponse clinique à 90 jours et qui ont été inclus dans la deuxième phase de l'étude, certains des patients maintenus sous Enbrel ont continué à s'améliorer entre le troisième mois et le septième mois, alors que ceux sous placebo ne se sont pas améliorés.
- Aucune étude n'a été réalisée chez les patients ayant une arthrite juvénile idiopathique polyarticulaire pour évaluer les effets de la poursuite du traitement par Enbrel chez les patients non répondeurs dans un délai de 3 mois après l'initiation du traitement par Enbrel, ni pour évaluer l'association Enbrel et méthotrexate.
- Anticorps contre Enbrel :
- Des anticorps contre Enbrel ont été détectés dans le sérum de patients traités par l'étanercept. Ces anticorps ont tous été non neutralisants et sont généralement transitoires. Il semble qu'il n'y ait aucune corrélation entre le développement d'anticorps et un effet clinique ou des effets secondaires.
- Chez les patients traités par des doses autorisées d'étanercept dans des études cliniques d'une durée supérieure à 12 mois, les taux cumulés d'anticorps anti-étanercept ont été approximativement de 6 % chez les sujets ayant une polyarthrite rhumatoïde, de 7,5 % chez les patients ayant un rhumatisme psoriasique, de 2 % chez les patients ayant une spondylarthrite ankylosante, de 7 % chez les patients atteints de psoriasis, de 9,7 % chez les enfants atteints de psoriasis et de 3 % chez les patients ayant une arthrite juvénile idiopathique.
- La proportion de patients qui ont développé des anticorps contre Enbrel dans des essais à long terme (plus de 3,5 ans) augmente avec le temps, comme attendu. Cependant, du fait de leur nature transitoire, l'incidence des anticorps détectés lors de chaque évaluation a été habituellement inférieure à 7 % chez les patients ayant une polyarthrite rhumatoïde et chez ceux atteints de psoriasis.
- Dans une étude à long terme dans le psoriasis où des patients ont reçu une dose de 50 mg deux fois par semaine pendant 96 semaines, l'incidence des anticorps observée lors de chaque évaluation a été approximativement de plus de 9 %.
PHARMACOCINÉTIQUE |
Les concentrations sériques d'étanercept ont été déterminées par la méthode Elisa, qui détecte les produits de dégradation réagissant au dosage Elisa ainsi que la molécule mère.
- Patients adultes :
- L'étanercept est absorbé lentement depuis le site d'injection sous-cutanée, atteignant une concentration maximale environ 48 heures après administration unique. La biodisponibilité absolue est de 76 %. Avec deux doses par semaine, on peut s'attendre à ce que les concentrations à l'équilibre représentent environ deux fois celles que l'on mesure après administration unique. Après l'administration unique en sous-cutanée de 25 mg d'Enbrel, la concentration sérique maximale moyenne observée chez les volontaires sains était de 1,65 µg/ml ± 0,66, l'aire sous la courbe étant de 235 µg × h/ml ± 96,6. La recherche d'une proportionnalité par rapport à la dose administrée n'a pas fait l'objet d'une évaluation particulière, mais il n'y a aucun signe de saturation de la clairance dans l'intervalle des posologies proposées.
- La courbe de concentration d'étanercept en fonction du temps est biexponentielle. Le volume de distribution central d'étanercept est de 7,6 l, alors que le volume de distribution à l'équilibre est de 10,4 l. L'étanercept est éliminé lentement par l'organisme. Sa demi-vie est longue, environ 70 heures. Sa clairance est d'environ 0,066 l/h chez les patients atteints de polyarthrite rhumatoïde, soit un peu moins que celle observée chez les volontaires sains (0,11 l/h). De plus, la pharmacocinétique d'Enbrel chez les patients atteints de polyarthrite rhumatoïde, de spondylarthrite ankylosante ou de psoriasis en plaques est similaire.
- Il a été démontré que les caractéristiques des concentrations sériques moyennes à l'équilibre, c'est-à-dire Cmax (2,4 mg/l vs 2,6 mg/l), Cmin (1,2 mg/l vs 1,4 mg/l) et l'aire sous la courbe (ASC) partielle (297 mg × h/l vs 316 mg × h/l) étaient comparables chez les patients atteints de PR et traités par 50 mg d'étanercept une fois par semaine (n = 21) et 25 mg d'étanercept deux fois par semaine (n = 16), respectivement. Dans une étude en ouvert, croisée, avec administration unique de deux posologies différentes chez des volontaires sains, il a été démontré que l'administration d'une injection unique de 50 mg/ml d'étanercept était bioéquivalente à deux injections simultanées de 25 mg/ml.
- Dans une analyse pharmacocinétique de patients atteints de spondylarthrite ankylosante, les ASC de l'étanercept à l'équilibre ont été de 466 µg × h/ml et de 474 µg × h/ml respectivement pour Enbrel 50 mg une fois par semaine (n = 154) et pour Enbrel 25 mg deux fois par semaine (n = 148).
- Bien que l'on détecte de la radioactivité dans les urines après l'administration d'étanercept radiomarqué à des patients et à des volontaires sains, aucune augmentation des concentrations d'étanercept n'a été observée chez les patients présentant une insuffisance rénale ou hépatique aiguë. La présence d'une insuffisance rénale ou hépatique ne devrait pas nécessiter d'ajustement de la posologie. Il n'existe apparemment aucune différence pharmacocinétique entre les hommes et les femmes.
- Le méthotrexate n'a pas d'effet sur la pharmacocinétique de l'étanercept ; l'effet d'Enbrel sur la pharmacocinétique du méthotrexate chez l'homme n'a pas été étudié.
- Populations particulières :
-
- Patients âgés :
- L'analyse des concentrations sériques d'étanercept dans le cadre des études de pharmacocinétique a été étudiée pour mesurer l'impact du grand âge. La clairance et le volume estimés chez les patients âgés de 65 à 87 ans étaient comparables aux estimations obtenues chez les patients âgés de moins de 65 ans.
-
- Enfants atteints d'arthrite juvénile idiopathique polyarticulaire (Enbrel seringue préremplie à 25 mg, flacon à 25 mg et flacon à 25 mg/ml pour usage pédiatrique) :
- Dans un essai d'Enbrel dans l'arthrite juvénile idiopathique polyarticulaire, 69 patients (âgés de 4 à 17 ans) ont reçu 0,4 mg d'Enbrel/kg deux fois par semaine pendant trois mois. Les courbes de concentration sérique étaient similaires à celles que l'on observe chez les patients adultes atteints de polyarthrite rhumatoïde. Les enfants les plus jeunes (âgés de 4 ans) ont eu une clairance réduite (clairance augmentée quand elle est ajustée au poids) en comparaison avec les enfants plus âgés (âgés de 12 ans) et les adultes. Une modélisation des dosages suggère que les enfants plus âgés (10 à 17 ans) aient des taux sériques proches de ceux des adultes, et que les plus jeunes enfants aient des taux notablement plus bas.
-
- Enfants atteints de psoriasis en plaques (Enbrel seringues préremplies à 25 mg et à 50 mg, flacon à 25 mg, flacon à 25 mg/ml pour usage pédiatrique et stylo prérempli à 50 mg) :
- Les enfants atteints de psoriasis en plaques (âgés de 4 à 17 ans) ont reçu 0,8 mg/kg (jusqu'à une dose maximale de 50 mg par semaine) d'étanercept une fois par semaine jusqu'à 48 semaines. Les concentrations sériques moyennes à l'équilibre ont varié de 1,6 à 2,1 µg/ml aux semaines 12, 24 et 48. Ces concentrations moyennes chez les enfants atteints de psoriasis en plaques ont été similaires aux concentrations observées chez les patients atteints d'arthrite juvénile idiopathique (traités par 0,4 mg/kg d'étanercept deux fois par semaine, jusqu'à une dose maximale de 50 mg par semaine). Ces concentrations moyennes étaient similaires à celles observées chez les patients adultes atteints de psoriasis en plaques traités par 25 mg d'étanercept deux fois par semaine.
SÉCURITE PRÉCLINIQUE |
Les études de toxicité d'Enbrel n'ont fait apparaître aucune dose limite toxique ni de toxicité vis-à-vis d'un organe cible. Au cours d'une batterie de tests réalisés in vitro et in vivo, Enbrel a été considéré non génotoxique. Les études de carcinogénicité et les évaluations standard de fertilité et de toxicité postnatales n'ont pas pu être réalisées avec Enbrel à cause du développement d'anticorps neutralisants chez les rongeurs.
Enbrel n'a pas induit de mortalité ou de signe notable de toxicité chez la souris ou le rat à la dose de 2000 mg/kg en administration unique sous-cutanée ou à la dose de 1000 mg/kg en injection unique par voie intraveineuse. Aucune dose limite toxique d'Enbrel ou de toxicité vis-à-vis d'un organe cible chez le singe cynomolgus n'ont été mises en évidence après administration deux fois par semaine en sous-cutané pendant 4 à 26 semaines consécutives d'une dose de 15 mg/kg. Cette dose correspond à une aire sous la courbe (AUC) des concentrations plasmatiques 27 fois supérieure à celle obtenue chez les hommes traités à la dose recommandée de 25 mg.
INCOMPATIBILITÉS |
En l'absence d'études de compatibilité, ce médicament ne doit pas être mélangé avec d'autres médicaments.
MODALITÉS DE CONSERVATION |
A conserver au réfrigérateur (entre + 2 °C et + 8 °C).
Ne pas congeler.
Conserver les seringues et stylos prérempli(e)s dans l'emballage extérieur à l'abri de la lumière.
- Durée de conservation des seringues préremplies et stylos à 25 mg et 50 mg :
- 30 mois.
- Durée de conservation des flacons pour usage pédiatrique et flacons à 25 mg :
- 3 ans.
- Enbrel 25 mg/ml pour usage pédiatrique :
- La stabilité physicochimique d'utilisation a été démontrée pendant 14 jours entre + 2 °C et + 8 °C après reconstitution. D'un point de vue microbiologique, une fois reconstitué, le produit doit être conservé pendant au maximum 14 jours entre + 2 °C et + 8 °C. Toutes autres durées et conditions de conservation avant utilisation sont de la responsabilité de l'utilisateur.
- Enbrel flacon à 25 mg poudre et solvant pour solution injectable :
- La stabilité physicochimique d'utilisation a été démontrée pendant 48 heures entre + 2 °C et + 8 °C après reconstitution. D'un point de vue microbiologique, le produit reconstitué doit être utilisé immédiatement. S'il n'est pas utilisé immédiatement, les délais et conditions de conservation avant utilisation sont sous la responsabilité de l'utilisateur et ne doivent normalement pas dépasser 6 heures à une température comprise entre + 2 °C et + 8 °C, à moins que la reconstitution n'ait eu lieu dans des conditions aseptiques contrôlées et validées.
MODALITÉS MANIPULATION/ÉLIMINATION |
Des instructions complètes pour l'administration de la seringue préremplie, pour l'administration et l'utilisation du stylo prérempli Myclic, ou pour la préparation, l'administration et la réutilisation du flacon reconstitué d'Enbrel sont données dans la notice.
Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
- Enbrel 25 mg ou 50 mg seringue préremplie :
- Avant l'injection, la seringue préremplie à usage unique d'Enbrel doit atteindre la température ambiante (environ 15 à 30 minutes). Le protège-aiguille ne doit pas être retiré pendant que la seringue atteint la température ambiante. La solution doit être limpide et incolore ou jaune pâle et pratiquement exempte de particules visibles.
- Enbrel 50 mg stylo prérempli :
- Avant l'injection, le stylo prérempli à usage unique d'Enbrel doit atteindre la température ambiante (environ 15 à 30 minutes). Le protège-aiguille ne doit pas être retiré pendant que la seringue atteint la température ambiante. Vue à travers la fenêtre d'inspection, la solution doit être limpide et incolore ou jaune pâle et pratiquement exempte de particules visibles.
- Enbrel 25 mg/ml pour usage pédiatrique :
- Enbrel est reconstitué avec 1 ml d'eau bactériostatique pour préparations injectables avant utilisation et administration de l'injection sous-cutanée. La solution doit être limpide et incolore à jaune pâle, sans amas, flocons ou particules visibles. Il se peut que de la mousse reste dans le flacon (ce qui est normal). Enbrel ne doit pas être utilisé si toute la poudre du flacon ne s'est pas dissoute dans les 10 minutes. Si tel est le cas, recommencer l'opération avec un autre flacon.
- Enbrel flacon à 25 mg :
- Enbrel est reconstitué avec 1 ml d'eau pour préparations injectables avant utilisation et administration de l'injection sous-cutanée. Enbrel ne contient aucun agent conservateur antibactérien, et les solutions préparées avec de l'eau pour préparations injectables doivent donc être administrées le plus vite possible, au plus tard dans les 6 heures qui suivent la reconstitution. La solution doit être limpide et incolore à jaune pâle, sans amas, flocons ou particules visibles. Il se peut que de la mousse reste dans le flacon (ce qui est normal). Enbrel ne doit pas être utilisé si toute la poudre du flacon ne s'est pas dissoute dans les 10 minutes. Si tel est le cas, recommencer l'opération avec un autre flacon.
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| Médicament soumis à prescription initiale hospitalière annuelle. Prescription initiale et renouvellement réservés aux spécialistes en rhumatologie, en médecine interne, en pédiatrie ou en dermatologie. | |
| AMM | EU/1/99/126/013 ; CIP 3400937719100 (2006, RCP rév 21.02.2011) 25 mg seringue. |
| EU/1/99/126/017 ; CIP 3400937719568 (2006, RCP rév 21.02.2011) 50 mg seringue. | |
| EU/1/99/126/020 ; CIP 3400939605227 (2009, RCP rév 21.02.2011) 50 mg stylo. | |
| EU/1/99/126/012 ; CIP 3400937684118 (2006, RCP rév 21.02.2011) 25 mg/ml flacon pour usage pédiatrique. | |
| EU/1/99/126/003 ; CIP 3400936064997 (2002, RCP rév 21.02.2011) 25 mg flacon. | |
| Prix : | 516.89 euros (4 seringues préremplies à 25 mg). |
| 1008.13 euros (4 seringues préremplies à 50 mg). | |
| 1008.13 euros (4 stylos préremplis à 50 mg). | |
| 516.89 euros (4 flacons à 25 mg/ml pour usage pédiatrique). | |
| 516.89 euros (4 flacons à 25 mg). | |
|
Remb Séc soc à 65 % selon la procédure des médicaments d'exception (prescription en conformité avec la fiche d'information thérapeutique). Collect. Seringues préremplies à 25 mg et à 50 mg, stylo prérempli à 50 mg et flacon à 25 mg : dans le psoriasis en plaques de l'adulte, l'indication ouvrant droit au remboursement est « Traitement du psoriasis en plaques grave chronique de l'adulte en cas d'échec ou de contre-indication ou d'intolérance à au moins 2 traitements systémiques parmi la ciclosporine, le méthotrexate et la puvathérapie ». |
|
| Inscrit sur la liste des spécialités prises en charge en sus des GHS. | |
Titulaire de l'AMM : Wyeth Europa Ltd.
PFIZER
23-25, av du Dr-Lannelongue. 75014 Paris
Tél : 01 58 07 30 00
Info médic : Tél : 01 58 07 34 40
