NOVORAPID®
insuline asparte
FORMES et PRÉSENTATIONS |
NovoRapid :
Solution injectable SC à 100 U/ml (aqueuse, limpide et incolore) : Flacon de 10 ml. NovoRapid FlexPen :
Solution injectable SC à 100 U/ml (aqueuse, limpide et incolore) : Cartouches de 3 ml en stylo injecteur multidose prérempli jetable, boîte de 5.
NovoRapid Penfill :
Solution injectable SC à 100 U/ml (aqueuse, limpide et incolore) : Cartouches de 3 ml, boîte de 5.
COMPOSITION |
NovoRapid :
| p flacon | |
| Insuline asparte* (DCI) | 1000 U |
NovoRapid FlexPen :
| p stylo | |
| Insuline asparte* (DCI) | 300 U |
NovoRapid Penfill :
| p cartouche | |
| Insuline asparte* (DCI) | 300 U |
1 ml de solution contient 100 U d'insuline asparte, soit 3,5 mg.
* Produite par la technique de l'ADN recombinant sur Saccharomyces cerevisiae.
INDICATIONS |
POSOLOGIE ET MODE D'ADMINISTRATION |
Posologie :
La posologie de NovoRapid dépend de chaque individu et est déterminée en fonction des besoins du patient. En règle générale, NovoRapid s'utilise en association avec une insuline à action prolongée ou intermédiaire, administrée au moins une fois par jour. Un contrôle glycémique et un ajustement de la posologie de l'insuline sont recommandés afin d'obtenir un équilibre glycémique optimal.
Les besoins individuels en insuline chez l'adulte et chez l'enfant se situent généralement entre 0,5 et 1 U/kg/jour. En cas d'administration dans un schéma de type basal-bolus, 50 à 70 % de ces besoins peuvent être couverts par NovoRapid et le restant par de l'insuline à action prolongée ou intermédiaire. Un ajustement de la posologie peut également être nécessaire si le patient modifie son activité physique, son régime alimentaire ou en cas de maladie concomitante.
- Populations particulières :
- Comme pour toutes les insulines, il est nécessaire d'intensifier le contrôle glycémique et d'ajuster la posologie de l'insuline asparte de façon individuelle chez les patients âgés et les patients atteints de troubles rénaux ou hépatiques.
- Utilisation chez l'enfant :
- Aucune étude n'a été réalisée chez l'enfant de moins de 2 ans. NovoRapid ne pourra être utilisé chez ces patients que sous contrôle médical attentif.
- Chez l'enfant, NovoRapid peut être préféré à l'insuline humaine soluble dans le cas où un délai d'action rapide peut se révéler utile comme, par exemple, pour planifier les injections par rapport aux repas (cf Pharmacodynamie, Pharmacocinétique).
- En remplacement d'autres insulines :
- NovoRapid présente un délai d'action plus rapide et une durée d'action plus courte que l'insuline humaine soluble. En cas d'injection sous-cutanée dans la paroi abdominale, l'insuline commence à agir dans les 10-20 minutes qui suivent l'injection. Son effet maximal apparaît de 1 à 3 heures après injection. Sa durée d'action est de 3 à 5 heures.
- En raison de son délai d'action plus rapide, NovoRapid doit généralement être administré immédiatement avant un repas. Si nécessaire, NovoRapid peut être injecté peu après un repas. Quel que soit le site d'injection, le délai d'action reste plus rapide que celui de l'insuline humaine. Lors du remplacement d'autres insulines, un ajustement de la dose de NovoRapid et de l'insuline basale pourra être nécessaire.
Mode d'administration :
- Administration avec une seringue (NovoRapid flacon), avec un stylo FlexPen (NovoRapid FlexPen) ou avec un système d'administration d'insuline (NovoRapid Penfill) :
- NovoRapid est administré par voie sous-cutanée par injection dans la paroi abdominale, la cuisse, le haut du bras, la région deltoïde ou la région fessière.
- Une rotation des sites d'injection devra toujours être effectuée au sein d'une même région. Comme pour toutes les insulines, l'absorption est plus rapide si l'injection est effectuée en sous-cutané dans la paroi abdominale plutôt que dans un autre site d'injection. La durée d'action varie en fonction de la dose, du site d'injection, du débit sanguin, de la température et de l'intensité de l'activité physique.
-
- FlexPen : NovoRapid FlexPen est un stylo prérempli conçu pour être utilisé avec les aiguilles NovoFine ou NovoTwist. FlexPen permet d'injecter 1 à 60 unités par paliers de 1 unité. NovoRapid FlexPen a un code couleur et est accompagné d'une notice dont les instructions doivent être respectées.
- Penfill : NovoRapid Penfill est conçu pour être utilisé avec les systèmes d'administration d'insuline Novo Nordisk et les aiguilles NovoFine ou NovoTwist. NovoRapid Penfill est accompagné d'une notice dont les instructions doivent être respectées.
- FlexPen : NovoRapid FlexPen est un stylo prérempli conçu pour être utilisé avec les aiguilles NovoFine ou NovoTwist. FlexPen permet d'injecter 1 à 60 unités par paliers de 1 unité. NovoRapid FlexPen a un code couleur et est accompagné d'une notice dont les instructions doivent être respectées.
- Perfusion sous-cutanée continue d'insuline (PSCI) :
- NovoRapid peut être administré par perfusion sous-cutanée continue d'insuline (PSCI) à l'aide d'une pompe à perfusion d'insuline. La PSCI sera administrée dans la paroi abdominale. Les sites de perfusion doivent être alternés.
- En cas d'utilisation dans une pompe à perfusion d'insuline, NovoRapid ne doit jamais être mélangé à une autre insuline.
- Les patients traités par PSCI recevront des instructions détaillées sur l'utilisation de la pompe et utiliseront le réservoir et la tubulure adaptés à la pompe (cf Modalités de manipulation et d'élimination). Le matériel de perfusion (tubulure et canule) doit être remplacé conformément aux instructions données dans la notice d'information jointe au matériel de perfusion.
- Lorsque NovoRapid est administré par PSCI, le patient doit disposer d'une autre source d'insuline qu'il utilisera en cas de panne de la pompe.
- Voie intraveineuse :
- Si nécessaire, NovoRapid peut également être administré en injection par voie intraveineuse par des professionnels de santé.
- Par voie intraveineuse, les systèmes de perfusion contenant NovoRapid 100 U/ml à des concentrations d'insuline asparte allant de 0,05 U/ml à 1,0 U/ml dans des solutés de perfusion de chlorure de sodium à 0,9 %, de glucose à 5 ou 10 % avec 40 mmol/l de chlorure de potassium restent stables à température ambiante durant 24 heures dans une poche à perfusion en polypropylène.
- Malgré leur stabilité dans le temps, une certaine quantité d'insuline s'adsorbera dès le départ à la poche à perfusion. La glycémie doit être contrôlée durant la perfusion d'insuline.
CONTRE-INDICATIONS |
MISES EN GARDE et PRÉCAUTIONS D'EMPLOI |
En général, les premiers symptômes de l'hyperglycémie apparaissent progressivement, en quelques heures ou quelques jours. Il s'agit d'une sensation de soif, de mictions plus fréquentes, de nausées, de vomissements, de somnolence, de sécheresse et rougeur cutanées, de sécheresse buccale, de perte d'appétit et d'odeur acétonique de l'haleine. Dans le diabète de type 1, les épisodes hyperglycémiques non traités peuvent conduire à une acidocétose diabétique, potentiellement létale.
Avant de voyager dans des pays avec des fuseaux horaires différents, le patient devra consulter son médecin dans la mesure où il devra éventuellement prendre son insuline et ses repas à des horaires différents.
- Hypoglycémie :
- L'omission d'un repas ou un exercice physique important non prévu peut entraîner une hypoglycémie.
- Une hypoglycémie peut survenir si la dose d'insuline est trop élevée pour les besoins du patient (cf Effets indésirables, Surdosage).
- Les patients dont le contrôle glycémique est nettement amélioré, par exemple dans le cadre d'une insulinothérapie intensifiée, peuvent constater un changement des signes précurseurs habituels d'hypoglycémie et doivent être avertis de cette éventualité. Les signes précurseurs habituels peuvent disparaître chez les patients présentant un diabète ancien.
- Compte tenu du mécanisme d'action (pharmacodynamie) des analogues de l'insuline à action rapide, un épisode hypoglycémique peut survenir plus rapidement après l'injection de cette insuline qu'après l'injection d'une insuline humaine soluble.
- Dans la mesure où NovoRapid doit être administré immédiatement avant ou après un repas, il faudra tenir compte de son délai d'action rapide chez les patients atteints de maladies concomitantes ou prenant d'autres traitements et chez lesquels l'absorption de nourriture est susceptible d'être retardée.
- Les maladies concomitantes, en particulier les infections et états fébriles, augmentent généralement les besoins en insuline du patient.
- Si le patient change de type d'insuline, les symptômes précurseurs d'hypoglycémie peuvent être modifiés ou devenir moins prononcés que ceux survenus avec sa précédente insuline.
- En remplacement d'autres insulines :
- En cas de changement de type ou de marque d'insuline, le patient devra faire l'objet d'un suivi médical attentif. Les changements de concentration, de marque (fabricant), de type, d'origine (animale, humaine, analogue de l'insuline humaine) et/ou de méthode de fabrication (ADN recombinant ou insuline d'origine animale) peuvent nécessiter un changement de posologie. Les patients qui passent à NovoRapid en remplacement d'un autre type d'insuline pourront nécessiter une augmentation du nombre d'injections quotidiennes ou une modification de la posologie par rapport à leurs insulines habituelles. Si un ajustement de la posologie s'avère nécessaire, il pourra être effectué dès la première injection ou pendant les premières semaines ou les premiers mois.
- Réactions au site d'injection :
- Comme avec toute insulinothérapie, des réactions au site d'injection peuvent survenir et se traduisent par l'un des signes suivants : douleur, rougeur, urticaire, inflammation, tuméfaction et prurit. Une rotation continue des sites d'injection dans une même région peut aider à diminuer ou éviter ces réactions. Ces réactions disparaissent généralement en l'espace de quelques jours à quelques semaines. Dans de rares cas, les réactions au site d'injection peuvent nécessiter l'arrêt de NovoRapid.
- Association de NovoRapid avec la pioglitazone :
- Des cas d'insuffisance cardiaque ont été rapportés lorsque la pioglitazone était utilisée en association avec de l'insuline, en particulier chez les patients présentant des facteurs de risque de survenue d'une insuffisance cardiaque. Ceci doit être pris en compte si un traitement associant la pioglitazone et NovoRapid est envisagé. Si une telle association est instaurée, il sera nécessaire de surveiller, chez ces patients, la survenue de signes et de symptômes d'insuffisance cardiaque, de prise de poids et d'oedème. La pioglitazone devra être arrêtée si une aggravation des symptômes d'insuffisance cardiaque survient.
INTERACTIONS |
Les substances suivantes peuvent réduire les besoins en insuline du patient : antidiabétiques oraux, inhibiteurs de la monoamine-oxydase (IMAO), bêtabloquants, inhibiteurs de l'enzyme de conversion de l'angiotensine (IEC), salicylés, stéroïdes anabolisants et sulfamides.
Les substances suivantes peuvent augmenter les besoins en insuline du patient : contraceptifs oraux, thiazidiques, glucocorticoïdes, hormones thyroïdiennes, sympathomimétiques, hormone de croissance et danazol.
Les bêtabloquants peuvent masquer les symptômes d'hypoglycémie.
L'octréotide et le lanréotide peuvent accroître ou réduire les besoins en insuline.
L'alcool peut intensifier ou réduire l'effet hypoglycémiant de l'insuline.
FERTILITÉ/GROSSESSE/ALLAITEMENT |
NovoRapid (insuline asparte) peut être utilisé chez la femme enceinte. Les données de deux essais cliniques randomisés contrôlés (322 et 27 femmes enceintes exposées) ne montrent pas d'effets délétères de l'insuline asparte sur la grossesse ou sur la santé du foetus/nouveau-né en comparaison à l'insuline humaine (cf Pharmacodynamie).
Chez la femme enceinte diabétique (diabète de type 1, diabète de type 2, diabète gestationnel), il est recommandé d'intensifier le contrôle glycémique et la surveillance tout au long de la grossesse ainsi qu'en cas de projet de grossesse. Les besoins en insuline chutent habituellement au cours du premier trimestre, puis augmentent au cours des deuxième et troisième trimestres. Après l'accouchement, les besoins en insuline reviennent généralement rapidement au niveau antérieur à la grossesse.
Allaitement :
L'administration de NovoRapid pendant l'allaitement ne fait l'objet d'aucune restriction.
L'insulinothérapie de la mère qui allaite ne présente aucun risque pour le bébé. Il peut cependant être nécessaire d'adapter la posologie de NovoRapid.
CONDUITE et UTILISATION DE MACHINES |
Les patients doivent être informés des précautions à prendre afin d'éviter toute hypoglycémie pendant la conduite de véhicules. Ceci est particulièrement important chez les patients peu ou mal familiarisés avec les signes précurseurs d'hypoglycémie ou sujets à de fréquents épisodes hypoglycémiques. Dans de telles circonstances, l'aptitude à conduire des véhicules doit être réévaluée.
EFFETS INDÉSIRABLES |
L'hypoglycémie est un effet indésirable fréquent. Celle-ci survient lorsque la dose d'insuline est trop importante par rapport aux besoins insuliniques. L'hypoglycémie sévère peut entraîner une perte de connaissance et/ou des convulsions et causer une altération transitoire ou définitive des fonctions cérébrales, voire le décès.
Lors des essais cliniques et depuis la mise sur le marché, la fréquence des hypoglycémies a varié en fonction de la population de patients et des doses utilisées, c'est pourquoi il n'est pas possible de l'évaluer.
Lors des essais cliniques, le taux moyen d'hypoglycémie n'a pas été différent entre les patients traités par l'insuline asparte et ceux traités par l'insuline humaine.
Les effets indésirables répertoriés ci-dessous sont classés par fréquence et selon le système de classification par organe. Les catégories de fréquence sont définies selon les conventions suivantes : très fréquent (>= 1/10) ; fréquent (>= 1/100, < 1/10) ; peu fréquent (>= 1/1000, <= 1/100) ; rare (>= 1/10 000, <= 1/1000) ; très rare (<= 1/10 000), fréquence indéterminée (ne peut être estimée à partir des données disponibles).
| Affections du système nerveux | |
| Rare | Neuropathie périphérique Une amélioration rapide du contrôle glycémique peut être associée à un état appelé neuropathie douloureuse aiguë, qui est habituellement réversible. |
| Affections oculaires | |
| Peu fréquent | Anomalies de la réfraction Des anomalies de la réfraction peuvent survenir au début de l'insulinothérapie. Ces symptômes sont habituellement transitoires. |
| Rétinopathie diabétique Une amélioration de l'équilibre glycémique à long terme diminue le risque de progression de la rétinopathie diabétique. Cependant, une intensification de l'insulinothérapie avec une amélioration soudaine de l'équilibre glycémique peut être associée à une aggravation transitoire de la rétinopathie diabétique. |
|
| Affections de la peau et du tissu sous-cutané | |
| Peu fréquent | Lipodystrophie L'apparition d'une lipodystrophie au niveau du site d'injection est possible lorsque l'alternance des sites d'injection au sein d'une même région n'est pas respectée. |
| Hypersensibilité locale Des réactions d'hypersensibilité locale (douleur, rougeur, urticaire, inflammation, tuméfaction et prurit au site d'injection) peuvent survenir au cours de l'insulinothérapie. Ces réactions sont habituellement transitoires et disparaissent généralement lors de la poursuite du traitement. |
|
| Troubles généraux et anomalies au site d'administration | |
| Peu fréquent | OEdème Un oedème peut survenir au début de l'insulinothérapie. Ces symptômes sont habituellement transitoires. |
| Affections du système immunitaire | |
| Peu fréquent | Urticaire, rash, éruptions |
| Très rare | Réactions anaphylactiques Les symptômes d'hypersensibilité généralisée peuvent inclure des éruptions cutanées généralisées, démangeaisons, sueurs, troubles gastro-intestinaux, oedème angioneurotique, difficultés respiratoires, palpitations et baisse de la pression artérielle. Les réactions d'hypersensibilité généralisée peuvent menacer le pronostic vital. |
SURDOSAGE |
- Les épisodes d'hypoglycémie modérée peuvent être traités par administration orale de glucose ou de produits sucrés. On conseille donc aux patients diabétiques d'avoir toujours sur eux des produits sucrés.
- Les épisodes d'hypoglycémie sévère, avec perte de connaissance, peuvent être traités par administration intramusculaire ou sous-cutanée de glucagon (0,5 à 1 mg) par une personne formée à cet effet ou par administration intraveineuse de glucose par le personnel médical. Si le patient ne répond pas au glucagon dans un délai de 10 à 15 minutes, du glucose devra aussi être administré par voie intraveineuse.
Dès que le patient a repris connaissance, une prise orale de glucides est recommandée afin de prévenir une rechute.
PHARMACODYNAMIE |
Classe pharmacothérapeutique : Insulines et analogues pour injection, d'action rapide (code ATC : A10AB05).
- Mécanisme d'action :
- L'effet hypoglycémiant de l'insuline asparte est dû à la liaison de l'insuline aux récepteurs des cellules musculaires et adipeuses facilitant ainsi l'assimilation du glucose et l'inhibition simultanée de la production hépatique de glucose.
- NovoRapid possède un délai d'action plus rapide que l'insuline humaine soluble ; de plus, la glycémie se maintient à des valeurs plus basses dans les quatre heures qui suivent le repas. Après injection sous-cutanée, la durée d'action de NovoRapid est inférieure à celle de l'insuline humaine soluble.
-
Glycémie après injection d'une dose de NovoRapid immédiatement avant un repas (courbe pleine) ou d'insuline humaine soluble 30 minutes avant un repas (courbe en pointillés) chez des patients diabétiques de type 1 : 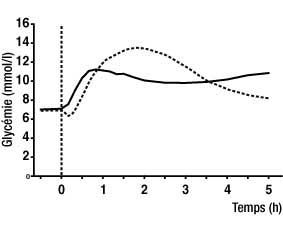
- Administré par voie sous-cutanée, NovoRapid commence à agir dans les 10 à 20 minutes qui suivent son injection. Son effet maximal apparaît de 1 à 3 heures après l'injection. Sa durée d'action est de 3 à 5 heures.
- Adultes :
- Chez des patients diabétiques de type 1, les essais cliniques ont montré que la glycémie postprandiale était inférieure à celle obtenue avec l'insuline humaine soluble (cf schéma ci-dessus). Lors de deux essais à long terme réalisés en ouvert chez des patients diabétiques de type 1 incluant respectivement 1070 et 884 patients, NovoRapid a réduit les concentrations d'hémoglobine glycosylée de 0,12 % [95 % IC 0,03 ; 0,22] et de 0,15 % [95 % IC 0,05 ; 0,26] par rapport à l'insuline humaine ; la significativité clinique de ces résultats n'est pas démontrée.
- Sujets âgés :
- Une étude PK/PD randomisée, en double aveugle, en cross-over, comparant l'insuline asparte à l'insuline humaine soluble a été réalisée chez des patients âgés diabétiques de type 2 (19 patients âgés de 65 à 83 ans, âge moyen : 70 ans). Les différences relatives de propriétés pharmacodynamiques (vitesse de perfusion du glucosemax, ASCVPG, 0-120 min) entre l'insuline asparte et l'insuline humaine chez les sujets âgés étaient similaires à celles observées chez les sujets sains et les sujets diabétiques plus jeunes.
- Enfants et adolescents :
- Un essai clinique comparant l'insuline humaine soluble administrée en préprandial avec l'insuline asparte administrée en postprandial a été réalisé chez des enfants en bas âge (20 patients âgés de 2 à moins de 6 ans, dont 4 âgés de moins de 4 ans, étude de 12 semaines) et une étude de pharmacocinétique/pharmacodynamie en dose unique a été réalisée chez des enfants (6 à 12 ans) et des adolescents (13 à 17 ans). Le profil pharmacodynamique de l'insuline asparte était similaire chez les enfants et les adultes.
- Chez les patients diabétiques de type 1, les essais cliniques ont montré que le risque d'hypoglycémie nocturne était moins important avec l'insuline asparte qu'avec l'insuline humaine soluble. Le risque d'hypoglycémie diurne n'augmente pas de façon significative.
- Grossesse :
- Un essai clinique comparant la tolérance et l'efficacité de l'insuline asparte versus l'insuline humaine dans le traitement du diabète de type 1 chez la femme enceinte (322 femmes enceintes exposées [insuline asparte : 157 ; insuline humaine : 165]) n'a pas montré d'effets délétères de l'insuline asparte sur la grossesse ou sur la santé du foetus/nouveau-né.
- Par ailleurs, un essai clinique comparant l'insuline asparte et l'insuline humaine mené chez 27 femmes présentant un diabète gestationnel (insuline asparte : 14 ; insuline humaine : 13) a montré des profils de tolérance similaires entre les traitements.
- En termes molaires, l'insuline asparte est équipotente à l'insuline humaine soluble.
PHARMACOCINÉTIQUE |
La substitution de l'acide aminé proline par de l'acide aspartique en position B28 réalisée sur NovoRapid réduit la tendance à la formation d'hexamères observée avec l'insuline humaine soluble.
NovoRapid est donc absorbé plus rapidement que l'insuline humaine soluble à partir du tissu sous-cutané.
En moyenne, le temps d'apparition de la concentration maximale est inférieur de moitié à celui de l'insuline humaine soluble. Chez des patients atteints de diabète de type 1, une concentration plasmatique maximale moyenne de 492 pmol/l ± 256 a été observée 40 minutes (écart interquartile : 30-40) après injection sous-cutanée d'une dose de 0,15 U/kg de poids corporel. Le retour aux concentrations d'insuline de départ se fait en 4 à 6 heures environ après l'injection. Une vitesse d'absorption légèrement plus lente a été observée chez les patients atteints de diabète de type 2, se traduisant par une Cmax inférieure (352 pmol/l ± 240) et un Tmax retardé à 60 minutes (écart interquartile : 50-90). La variabilité intra-individuelle du temps d'apparition de la concentration maximale est significativement moins importante pour NovoRapid que pour l'insuline humaine soluble ; par contre, la variabilité intra-individuelle de Cmax est plus importante avec NovoRapid.
- Enfants et adolescents :
- Les propriétés pharmacocinétiques et pharmacodynamiques de NovoRapid ont été étudiées chez des enfants (6 à 12 ans) et des adolescents (13 à 17 ans) atteints de diabète de type 1.
- L'insuline asparte a été absorbée rapidement dans les deux groupes, avec un Tmax équivalent à celui de l'adulte. Cependant, une variation de la Cmax a été observée en fonction de l'âge, ce qui souligne l'importance du dosage individuel de NovoRapid.
- Sujets âgés :
- Les différences relatives de propriétés pharmacocinétiques entre l'insuline asparte et l'insuline humaine soluble chez les sujets âgés diabétiques de type 2 (65 à 83 ans, âge moyen : 70 ans) étaient similaires à celles observées chez les sujets sains et les sujets diabétiques plus jeunes. Une diminution du taux d'absorption a été observée chez les sujets âgés, induisant un Tmax retardé (82, écart interquartile : 60-120 minutes), alors que la Cmax était similaire à celle observée chez les sujets diabétiques de type 2 plus jeunes et légèrement plus basse que chez les sujets diabétiques de type 1.
- Insuffisance hépatique :
- Une étude de pharmacocinétique à dose unique d'insuline asparte a été réalisée chez 24 sujets ayant une fonction hépatique normale à sévèrement altérée. Chez les sujets ayant une insuffisance hépatique, le taux d'absorption était diminué et plus variable, induisant un Tmax retardé de 50 min chez les sujets ayant une fonction hépatique normale à 85 min chez les sujets avec des troubles hépatiques modérés à sévères. L'ASC, Cmax, et CL/F étaient similaires chez les sujets ayant une fonction hépatique diminuée en comparaison aux sujets ayant une fonction hépatique normale.
- Insuffisance rénale :
- Une étude de pharmacocinétique à dose unique d'insuline asparte a été réalisée chez 18 sujets ayant une fonction rénale normale à sévèrement altérée. Aucun effet apparent de la clairance de la créatinine sur les valeurs de l'ASC, CL/F, et le Tmax de l'insuline asparte n'a été mis en évidence. Les données sont limitées chez les sujets ayant une insuffisance rénale sévère à modérée. Les sujets ayant une insuffisance rénale nécessitant un traitement par dialyse n'ont pas été étudiés.
SÉCURITE PRÉCLINIQUE |
Les données non cliniques issues des études conventionnelles de pharmacologie de sécurité, toxicologie en administration répétée, génotoxicité, et des fonctions de reproduction, n'ont pas révélé de risque particulier pour l'homme.
Lors des essais in vitro évaluant à la fois la liaison aux récepteurs de l'insuline et de l'IGF-1 et les effets sur la croissance cellulaire, l'insuline asparte s'est comportée de façon très similaire à l'insuline humaine. Les études ont également montré que la dissociation de la liaison sur le récepteur à l'insuline était identique à celle de l'insuline humaine.
INCOMPATIBILITÉS |
Certaines substances mélangées à NovoRapid peuvent entraîner une dégradation de l'insuline asparte : c'est le cas des médicaments contenant des thiols ou des sulfites.
Ce médicament ne doit pas être mélangé à d'autres médicaments. Les exceptions sont l'insuline NPH (Neutral Protamine Hagedorn) et les liquides de perfusion décrits dans la rubrique Posologie et Mode d'administration.
MODALITÉS DE CONSERVATION |
- Durée de conservation :
- 30 mois.
A conserver au réfrigérateur (entre 2 °C et 8 °C). Maintenir à distance de l'élément de refroidissement. Ne pas congeler.
- Flacon, cartouche : Conserver le flacon et la cartouche dans l'emballage extérieur, à l'abri de la lumière.
- Stylo : Conserver le capuchon sur NovoRapid FlexPen, à l'abri de la lumière.
- Après 1re ouverture ou gardé sur soi en réserve :
- Ne pas mettre au réfrigérateur. A conserver pendant 4 semaines au maximum à une température ne dépassant pas 30 °C.
NovoRapid doit être conservé à l'abri de la chaleur excessive et de la lumière.
MODALITÉS MANIPULATION/ÉLIMINATION |
NovoRapid peut être utilisé dans une pompe à perfusion (PSCI) comme décrit dans la rubrique Posologie et Mode d'administration. Les tubulures, dont le revêtement interne est en polyéthylène ou polyoléfine, ont été évaluées et sont compatibles.
NovoRapid ne doit pas être utilisé si la solution n'est pas limpide et incolore.
NovoRapid ne doit pas être utilisé s'il a été congelé.
- Flacon :
- Les flacons de NovoRapid doivent être utilisés avec des seringues à insuline portant une graduation adéquate.
- Stylo, cartouche :
- NovoRapid FlexPen et NovoRapid Penfill sont réservés à l'utilisation par un seul patient. Les cartouches ne doivent pas être reremplies.
- Le patient sera averti du fait qu'il doit jeter l'aiguille après chaque injection.
- En cas d'urgence (hospitalisation ou mauvais fonctionnement du stylo d'insuline), NovoRapid peut être prélevé dans un stylo FlexPen ou dans une cartouche Penfill à l'aide d'une seringue de 100 U.
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| AMM | EU/1/99/119/001 ; CIP 3400935259097 (RCP rév 17.02.2011) flacon. |
| EU/1/99/119/009 ; CIP 3400935527400 (RCP rév 17.02.2011) stylo. | |
| EU/1/99/119/003 ; CIP 3400935259219 (RCP rév 17.02.2011) cartouche. |
| Prix : | 21.65 euros (flacon de 10 ml). |
| 43.18 euros (5 stylos FlexPen). | |
| 39.74 euros (5 cartouches Penfill). | |
| Remb Séc soc à 65 %. Collect. | |
Titulaire de l'AMM : Novo Nordisk A/S, Danemark.
Représentant local :
NOVO NORDISK
Coeur Défense
100, av du Général-de-Gaulle
92400 Courbevoie
Tél : 01 41 97 66 00. Fax : 01 41 97 66 01
Info médic et pharma :
Tél Vert : 08 00 80 30 70
Site web : http://www.novonordisk.fr
