SPIRIVA RESPIMAT®
tiotropium bromure
FORMES et PRÉSENTATIONS |
COMPOSITION |
| p dose | |
| Tiotropium | 2,5 µg |
| (sous forme de bromure de tiotropium [DCI] monohydraté : 3,124 µg/dose) | |
La dose délivrée correspond à la quantité de tiotropium délivré après passage à travers l'embout buccal.
INDICATIONS |
POSOLOGIE ET MODE D'ADMINISTRATION |
Voie inhalée exclusivement.
La cartouche ne peut être utilisée qu'avec le dispositif d'inhalation Respimat (cf Mode d'administration).
La posologie recommandée chez l'adulte est de 5 µg de tiotropium administrée à l'aide de l'inhalateur Respimat, soit deux bouffées doses une fois par jour, à heure fixe dans la journée.
Ne pas dépasser la dose recommandée.
Coût du traitement journalier : 1,36 euro(s).- Populations particulières :
-
- Sujets âgés : le bromure de tiotropium peut être utilisé chez les sujets âgés sans adaptation de la posologie.
- Insuffisance rénale : en cas d'insuffisance rénale, le bromure de tiotropium peut être utilisé sans adaptation de la posologie. En cas d'insuffisance rénale modérée à sévère (clairance de la créatinine <= 50 ml/ min) : cf Mises en garde et Précautions d'emploi, Pharmacocinétique.
- Insuffisance hépatique : en cas d'insuffisance hépatique, le bromure de tiotropium peut être utilisé sans adaptation de la posologie.
- Utilisation pédiatrique : en l'absence de données d'efficacité et de tolérance dans cette population de patients, l'utilisation de Spiriva Respimat est déconseillée chez l'enfant et l'adolescent de moins de 18 ans (cf Pharmacodynamie, Pharmacocinétique).
- Sujets âgés : le bromure de tiotropium peut être utilisé chez les sujets âgés sans adaptation de la posologie.
Pour une administration correcte du médicament, le médecin ou un autre professionnel de santé devra s'assurer du bon usage de l'appareil par le patient.
Mode d'administration :
- Instructions destinées aux patients pour l'utilisation et la manipulation :
-
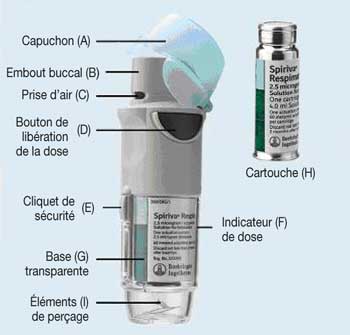
Inhalateur Spiriva Respimat et cartouche Spiriva Respimat.
-
- Insertion de la cartouche et préparation à l'emploi :
- Les étapes suivantes 1 à 6 sont nécessaires avant la première utilisation :
-
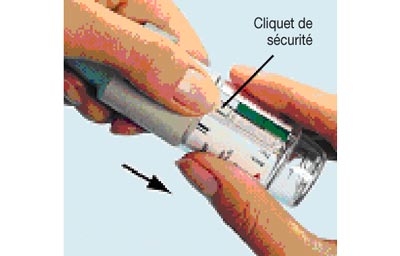
- 1. Tout en maintenant le capuchon vert (A) fermé, appuyer sur le cliquet de sécurité (E) et retirer la base transparente (G).
- 2. Sortir la cartouche (H) de la boîte ; pousser l'extrémité la plus étroite de la cartouche dans l'inhalateur jusqu'à ce qu'elle s'enclenche.
Pousser doucement le fond de la cartouche contre une surface solide afin d'assurer qu'elle pénètre entièrement dans l'inhalateur. Ne plus tenter de retirer la cartouche lorsqu'elle a été insérée dans l'inhalateur.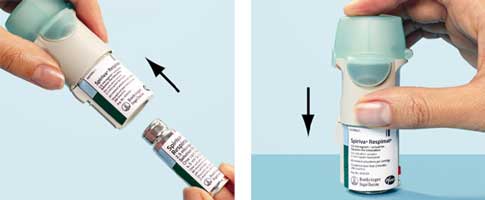
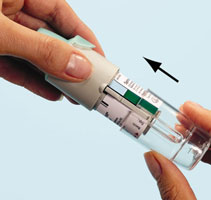
- 3. Remettre en place la base transparente (G). Ne plus retirer la base transparente.
- 1. Tout en maintenant le capuchon vert (A) fermé, appuyer sur le cliquet de sécurité (E) et retirer la base transparente (G).
-
- Préparation de l'inhalateur Spiriva Respimat pour la première utilisation :
-
- 4. Maintenir l'inhalateur Spiriva Respimat verticalement, avec le capuchon vert (A) fermé. Tourner la base (G) dans la direction des flèches rouges imprimées sur l'étiquette jusqu'à entendre un déclic (un demi-tour).
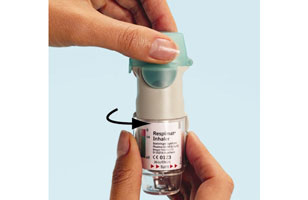
- 5. Ouvrir le capuchon vert (A) jusqu'à ce qu'il s'ouvre complètement (avec un claquement).
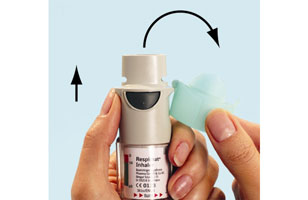
- 6. Diriger l'inhalateur Spiriva Respimat en direction du sol puis appuyer sur le bouton de libération de la dose (D). Fermer le capuchon vert (A).
Répéter les étapes 4, 5 et 6 jusqu'à ce qu'un nuage soit visible. Puis répéter les étapes 4, 5 et 6 trois autres fois afin d'assurer que l'inhalateur est prêt à être utilisé.
L'inhalateur Spiriva Respimat est maintenant prêt à l'emploi. Ces étapes n'affecteront pas le nombre de doses disponibles. Après cette préparation, l'inhalateur Spiriva Respimat pourra délivrer 60 bouffées (correspondant à 30 jours de traitement).
- 4. Maintenir l'inhalateur Spiriva Respimat verticalement, avec le capuchon vert (A) fermé. Tourner la base (G) dans la direction des flèches rouges imprimées sur l'étiquette jusqu'à entendre un déclic (un demi-tour).
-
- Utilisation de l'inhalateur Spiriva Respimat :
- Il n'y aura besoin d'utiliser cet inhalateur qu'une seule fois par jour.
- A chaque utilisation, prendre 2 bouffées.
-
- Maintenir l'inhalateur Spiriva Respimat en position verticale, avec le capuchon vert (A) fermé, afin d'éviter la libération accidentelle d'une dose. Tourner la base (G) dans la direction des flèches rouges imprimées sur l'étiquette jusqu'à entendre un déclic (un demi-tour).
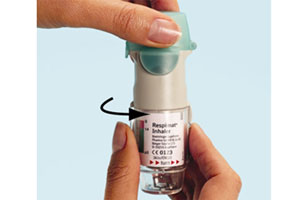
- Ouvrir le capuchon vert (A) jusqu'à ce qu'il s'ouvre complètement (avec un claquement). Expirer lentement et complètement, puis fermer les lèvres autour de l'extrémité de l'embout buccal sans recouvrir les prises d'air (C). Diriger l'inhalateur Spiriva Respimat vers le fond de la gorge. Tout en prenant une inspiration lente et profonde par la bouche, appuyer sur le bouton de libération de la dose (D), et continuer d'inspirer lentement aussi longtemps que possible. Retenir sa respiration pendant 10 secondes ou aussi longtemps que cela est possible sans être gêné.
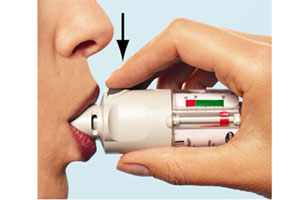
- Répéter les deux étapes ci-dessus afin de recevoir la quantité recommandée de médicament (2 bouffées).
Il n'est nécessaire d'utiliser cet inhalateur qu'une seule fois par jour.
Fermer le capuchon vert jusqu'à l'utilisation suivante de l'inhalateur Spiriva Respimat.
Si l'inhalateur Spiriva Respimat n'a pas été utilisé pendant plus de 7 jours, libérer une bouffée vers le sol.
Si l'inhalateur Spiriva Respimat n'a pas été utilisé pendant plus de 21 jours, reprendre les étapes 4 à 6 jusqu'à ce qu'un nuage soit visible. Puis, répéter les étapes 4 à 6 trois autres fois.
- Maintenir l'inhalateur Spiriva Respimat en position verticale, avec le capuchon vert (A) fermé, afin d'éviter la libération accidentelle d'une dose. Tourner la base (G) dans la direction des flèches rouges imprimées sur l'étiquette jusqu'à entendre un déclic (un demi-tour).
-
- Quand se procurer un nouvel inhalateur Spiriva Respimat :
- L'inhalateur Spiriva Respimat contient 60 bouffées (correspondant à 30 jours de traitement). L'indicateur de doses montre approximativement la quantité de médicament restant dans l'inhalateur. Lorsque l'indicateur entre dans la zone rouge de l'échelle, il reste suffisamment de médicament pour environ 7 jours de traitement (14 bouffées). C'est le moment où le patient devra renouveler la prescription pour un nouvel inhalateur Spiriva Respimat. Lorsque l'indicateur de doses atteint la fin de l'échelle rouge (c'est-à-dire que l'ensemble des 60 bouffées auront été administrées), l'inhalateur Spiriva Respimat est vide et se bloque automatiquement. A ce stade, la base ne peut plus être tournée.
- L'inhalateur Spiriva Respimat doit être jeté au plus tard après 3 mois d'utilisation, même si la totalité du médicament n'a pas été utilisée.
-

-
- Comment entretenir l'inhalateur :
-
- Nettoyer l'embout buccal, y compris la partie métallique à l'intérieur de l'embout buccal, avec un linge ou un tissu humide uniquement, au moins une fois par semaine.
- Une décoloration mineure de l'embout buccal n'affecte pas les performances de l'inhalateur Spiriva Respimat.
- Le cas échéant, essuyer l'extérieur de l'inhalateur Spiriva Respimat avec un linge humide.
- Nettoyer l'embout buccal, y compris la partie métallique à l'intérieur de l'embout buccal, avec un linge ou un tissu humide uniquement, au moins une fois par semaine.
CONTRE-INDICATIONS |
MISES EN GARDE et PRÉCAUTIONS D'EMPLOI |
Des réactions d'hypersensibilité immédiate peuvent survenir après l'administration du bromure de tiotropium, solution pour inhalation.
En raison de son activité anticholinergique, le bromure de tiotropium doit être utilisé avec prudence en cas de glaucome à angle fermé, d'hypertrophie de la prostate ou de rétrécissement du col de la vessie.
D'une façon générale, l'administration par voie inhalée des médicaments est susceptible de déclencher un bronchospasme.
Spiriva Respimat devra être utilisé avec prudence chez les patients ayant un trouble du rythme cardiaque connu (cf Pharmacodynamie).
Les concentrations plasmatiques de bromure de tiotropium augmentent en cas d'altération de la fonction rénale ; par conséquent, chez les patients atteints d'insuffisance rénale modérée à sévère (clairance de la créatinine <= 50 ml/min), le produit ne sera utilisé que si le bénéfice attendu dépasse le risque potentiel. A ce jour, il n'y a pas d'expérience à long terme chez les patients souffrant d'insuffisance rénale sévère (cf Pharmacocinétique).
Il conviendra d'avertir les patients du risque de déclenchement ou d'aggravation d'un glaucome à angle fermé, de douleur ou gêne oculaire, de vision floue transitoire avec halo visuel coloré associé à une rougeur et un oedème cornéoconjonctival, en cas de projection intraoculaire du produit. Si une combinaison quelconque de ces symptômes oculaires apparaît, les patients doivent interrompre l'utilisation du bromure de tiotropium et consulter immédiatement un spécialiste.
La sécheresse buccale observée avec les traitements anticholinergiques en général, peut à long terme favoriser la survenue de caries dentaires.
La posologie du bromure de tiotropium ne doit pas dépasser une prise par jour (cf Surdosage).
INTERACTIONS |
Il n'a pas été effectué d'étude spécifique d'interaction avec le bromure de tiotropium. Néanmoins, il n'a pas été rapporté de manifestation clinique évoquant une interaction médicamenteuse lors de l'administration concomitante d'autres médicaments habituellement utilisés dans la bronchopneumopathie chronique obstructive (BPCO) notamment bronchodilatateurs sympathomimétiques, des méthylxanthines, des stéroïdes oraux et inhalés.
La co-administration de bromure de tiotropium avec d'autres médicaments à activité anticholinergique n'a pas été étudiée et n'est par conséquent, pas recommandée.
GROSSESSE et ALLAITEMENT |
Il n'y a pas de données cliniques documentées relatives à l'exposition de la femme enceinte au bromure de tiotropium.
Les études de reproduction menées chez l'animal ont montré un effet toxique sur la reproduction associé à une toxicité maternelle (cf Sécurité préclinique).
Le risque potentiel dans l'espèce humaine est inconnu. Spiriva Respimat ne doit par conséquent être administré au cours de la grossesse qu'en cas d'indication justifiée.
Allaitement :
L'excrétion du bromure de tiotropium dans le lait maternel n'a pas été établie. Bien que les études réalisées chez les rongeurs n'aient retrouvé une excrétion du bromure de tiotropium dans le lait maternel qu'en faibles quantités, l'utilisation de Spiriva Respimat n'est pas recommandée au cours de l'allaitement. Le bromure de tiotropium est un composé de longue durée d'action. La décision de poursuivre ou d'interrompre l'allaitement ou le traitement par Spiriva Respimat doit être prise en tenant compte du bénéfice de l'allaitement chez l'enfant et du bénéfice du traitement par Spiriva Respimat chez la mère.
CONDUITE et UTILISATION DE MACHINES |
EFFETS INDÉSIRABLES |
- Description générale :
- Un grand nombre des effets indésirables rapportés peuvent être attribués aux propriétés anticholinergiques du bromure de tiotropium.
- Tableau des effets indésirables selon la terminologie MedDRA :
- Les fréquences des effets indésirables présentés ci-dessous sont basées sur les taux d'incidence brute des effets indésirables observés dans le groupe traité par le tiotropium (2802 patients) - c'est-à-dire les événements imputables au tiotropium - regroupés à partir des données de 5 études cliniques contre placebo dont les durées de traitement étaient comprises entre 12 semaines et 1 an.
- La fréquence est définie selon la classification conventionnelle : très fréquent (>= 1/10), fréquent (>= 1/100, < 1/10), peu fréquent (>= 1/1000, < 1/100), rare (>= 1/10 000, < 1/1000), très rare (< 1/10 000), non déterminé (fréquence ne pouvant être estimée sur la base des données disponibles).
-
Classe d'organes/Terme MedDRA recommandé Fréquence Troubles du métabolisme et de la nutrition : Déshydratation Non déterminé* Affections du système nerveux : Étourdissements Peu fréquent Céphalées Peu fréquent Insomnies Non déterminé* Affections oculaires : Vision trouble Rare Augmentation de la pression intraoculaire Rare Glaucome Rare Affections cardiaques : Palpitations Peu fréquent Tachycardie supraventriculaire Peu fréquent Fibrillation auriculaire Peu fréquent Tachycardie Peu fréquent Affections respiratoires, thoraciques et médiastinales : Toux Peu fréquent Pharyngite Peu fréquent Dysphonie Peu fréquent Bronchospasme Rare Épistaxis Peu fréquent Sinusite Non déterminé* Laryngite Rare Affections gastro-intestinales : Sécheresse buccale Fréquent Candidose oropharyngée Peu fréquent Reflux gastro-oesophagien Rare Dysphagie Peu fréquent Caries dentaires Rare Gingivite Rare Glossite Rare Stomatite Rare Constipation Peu fréquent Occlusion intestinale, y compris iléus paralytique Non déterminé* Nausées Non déterminé* Affections de la peau et du tissu sous-cutané, affections du système immunitaire : Prurit Peu fréquent OEdème de Quincke Rare Éruption cutanée Peu fréquent Infection cutanée/ulcération cutanée Rare Sécheresse cutanée Rare Urticaire Rare Hypersensibilité (y compris réactions immédiates) Non déterminé* Troubles musculosquelettiques et du tissu conjonctif : Gonflement articulaire Non déterminé* Affections du rein et des voies urinaires : Dysurie Peu fréquent Rétention urinaire Peu fréquent Infection du tractus urinaire Rare -
*
Fréquence non déterminée, aucun effet indésirable rapporté chez les 2802 patients des études cliniques.
- Informations caractérisant les effets indésirables individuels graves et/ou fréquents :
- Dans les essais cliniques contrôlés, les effets indésirables le plus fréquemment observés ont été les effets indésirables de type anticholinergique tels que la sécheresse buccale survenue chez environ 3,2 % des patients.
- Dans 5 essais cliniques, la sécheresse buccale a été à l'origine de 3 arrêts de traitement parmi les 2802 patients traités par le tiotropium (soit 0,1 % des patients traités).
- Les effets indésirables graves liés aux effets anticholinergiques incluent glaucome, constipation, occlusion intestinale y compris iléus paralytique et rétention urinaire.
- Informations complémentaires sur les populations particulières :
- L'incidence des effets anticholinergiques peut augmenter avec l'âge.
SURDOSAGE |
Cependant, l'inhalation d'une dose unique allant jusqu'à 340 µg de bromure de tiotropium n'a été suivie d'aucun effet indésirable de type anticholinergique systémique chez des volontaires sains. En outre, aucun effet indésirable significatif, hormis une sécheresse buccale, pharyngée ou nasale, n'a été observé après 14 jours d'administration de doses atteignant 40 µg de bromure de tiotropium solution pour inhalation chez des volontaires sains, à l'exception d'une réduction prononcée de la production de salive à partir du 7e jour. Aucun effet indésirable significatif n'a été observé au cours de quatre études à long terme effectuées chez des patients atteints de BPCO traités avec une dose quotidienne de 10 µg de tiotropium solution pour inhalation administrée pendant des périodes comprises entre 4 et 48 semaines.
Une intoxication aiguë par ingestion orale accidentelle de tiotropium solution pour inhalation à partir de la cartouche est peu probable compte tenu de sa faible biodisponibilité par voie orale.
PHARMACODYNAMIE |
Classe pharmacothérapeutique : anticholinergiques (code ATC : R03BB04).
Le bromure de tiotropium est un antagoniste spécifique de longue durée d'action des récepteurs muscariniques, qui montre une affinité similaire pour les sous-types de récepteurs muscariniques M1 à M5. Dans les voies aériennes, le bromure de tiotropium se fixe de façon compétitive et réversible sur les récepteurs M3 des muscles lisses bronchiques et inhibe les effets cholinergiques (bronchoconstriction) de l'acétylcholine entraînant ainsi une relaxation des muscles lisses bronchiques. L'effet est dose-dépendant et persiste plus de 24 heures. Anticholinergique de type ammonium quaternaire, le bromure de tiotropium exerce une action topique (bronchique) sélective, lorsqu'il est administré par inhalation, et offre ainsi une marge thérapeutique acceptable avant l'apparition des effets anticholinergiques systémiques.
La dissociation du tiotropium des récepteurs M3 notamment est très lente, lui conférant une demi-vie de dissociation significativement plus longue que l'ipratropium. Le tiotropium se dissocie plus rapidement des récepteurs M2 que des récepteurs M3, comme le suggèrent les études in vitro, marquant une sélectivité plus importante (exprimée de façon cinétique) pour les récepteurs de type M3 par rapport à M2.
La forte activité, la très lente dissociation des récepteurs et la sélectivité topique de l'administration par inhalation se traduisent sur le plan clinique par une bronchodilatation significative et prolongée chez les patients atteints de BPCO.
Le programme de développement clinique de phase III de Spiriva Respimat a été composé de plusieurs études randomisées et en double aveugle (deux études de 1 an, deux études de 12 semaines et deux études de 4 semaines) portant sur 2901 patients atteints de BPCO (1038 recevant la dose de 5 µg de tiotropium). Le programme de 1 an a été composé de deux essais contrôlés par placebo. Les deux études de 12 semaines ont été contrôlées par un traitement actif (ipratropium) et par un placebo. L'ensemble des six études a comporté des mesures de la fonction pulmonaire. Les deux études de 1 an ont inclus les mesures de la dyspnée, de la qualité de vie relative à l'état de santé et la survenue d'exacerbations. Dans ces études, le tiotropium solution pour inhalation, administré une fois par jour, a apporté des améliorations significatives de la fonction pulmonaire (volume expiratoire maximum par seconde et capacité vitale forcée) dans un délai de 30 minutes suivant la première dose, par rapport au placebo (amélioration moyenne du VEMS à 30 minutes : 0,113 litres ; intervalle de confiance IC95 % : 0,102 à 0,125 litres, p < 0,0001). A l'état d'équilibre, l'amélioration de la fonction pulmonaire a été maintenue pendant 24 heures, par rapport au placebo (amélioration moyenne du VEMS : 0,122 litres ; IC95 % : 0,106 à 0,138 litres, p < 0,0001). L'état d'équilibre pharmacodynamique a été atteint en 1 semaine.
Spiriva Respimat a significativement amélioré, comparativement au placebo, le débit expiratoire de pointe (DEP) mesuré quotidiennement par les patients, (amélioration moyenne du DEP le matin : 22 l/min ; IC95 % : 18 à 55 l/min, p < 0,0001 ; le soir : 26 l/min ; IC95 % : 23 à 30 l/min, p < 0,0001). L'utilisation de Spiriva Respimat a entraîné une réduction de l'utilisation du traitement bronchodilatateur de secours par rapport au placebo (réduction moyenne de 0,66 prise par jour, IC95 % : 0,51 à 0,81 prise par jour, p < 0,0001).
L'effet bronchodilatateur de Spiriva Respimat s'est maintenu pendant une période de 12 mois d'administration sans signe d'induction d'une tolérance.
Les résultats cliniques suivants ont été mis en évidence au cours d'études à long terme d'une durée de 1 an :- Spiriva Respimat a amélioré de façon significative la dyspnée (évaluée par l'index de dyspnée de transition) comparativement au placebo (amélioration moyenne de 1,05 unités ; IC95 % : 0,73 à 1,38 unités, p < 0,0001). Cette amélioration s'est maintenue pendant toute la période de traitement.
- L'amélioration du score total moyen de la qualité de vie évalué par les patients eux-mêmes au moyen du questionnaire respiratoire de St-George, (SGRQ) obtenue avec Spiriva Respimat à la fin des deux études de 1 an a été de 3,5 unités par rapport au placebo (IC95 % : 2,1 à 4,9, p < 0,0001). Une diminution de 4 unités est considérée comme cliniquement significative.
- Exacerbations de BPCO :
Dans trois études cliniques randomisées d'une durée de 1 an, conduites en double aveugle, contre placebo, le traitement par Spiriva Respimat a entraîné une réduction significative du risque d'exacerbation de BPCO par rapport au placebo. Les exacerbations de BPCO ont été définies de la façon suivante : association d'au moins deux événements ou symptômes respiratoires persistants pendant au moins 3 jours et ayant conduit à un traitement spécifique (prescription d'antibiotiques et/ou de corticostéroïdes systémiques et/ou modification significative du traitement à visée respiratoire).
Le traitement par Spiriva Respimat a entraîné une réduction du risque d'hospitalisations en relation avec une exacerbation de BPCO (statistiquement significatif dans l'étude qui présente la puissance appropriée).
L'analyse combinée de deux études de phase III et l'analyse distincte d'une étude supplémentaire sur les exacerbations sont présentées dans le tableau 1. Tous les traitements à visée respiratoire, à l'exception des anticholinergiques et des ß-mimétiques d'action prolongée, étaient autorisés en traitements concomitants, consistants en ß-mimétiques d'action rapide, corticostéroïdes inhalés et xanthines. Les ß-mimétiques d'action prolongée ont été autorisés en traitement complémentaire dans l'étude sur les exacerbations.Tableau 1 : Analyse statistique des exacerbations de BPCO et des exacerbations de BPCO ayant nécessité une hospitalisation chez les patients présentant une BPCO modérée à très sévère Étude (Nspiriva Nplacebo) :
CritèreSpiriva Respimat Placebo % de réduction du risque (IC à 95 %)(1) Valeur de p Analyse combinée des études de phase III de 1 an(4) (670, 653) : Nombre de jours avant la première exacerbation de BPCO 160(1) 86(1) 29 (16 à 40)(2) < 0,0001(2) Incidence moyenne des exacerbations par patient-année 0,78(3) 1,00(3) 22 (8 à 33)(3) 0,002(3) Délai avant la première exacerbation de BPCO ayant nécessité une hospitalisation 25 (- 16 à 51)(2) 0,20(2) Incidence moyenne des exacerbations ayant nécessité une hospitalisation par patient-année 0,09(3) 0,11(3) 20 (- 4 à 38)(3) 0,096(3) Étude sur les exacerbations de phase IIIb de 1 an (1939, 1953) : Nombre de jours avant la première exacerbation de BPCO 169(1) 119(1) 31 (23 à 37)(2) < 0,0001(2) Incidence moyenne des exacerbations par patient-année 0,69(3) 0,87(3) 21 (13 à 28)(3) < 0,0001(3) Délai avant la première exacerbation de BPCO ayant nécessité une hospitalisation 27 (10 à 41)(2) 0,003(2) Incidence moyenne des exacerbations ayant nécessité une hospitalisation par patient-année 0,12(3) 0,15(3) 19 (7 à 30)(3) 0,004(3)
(1) Délai avant le premier événement : nombre de jours sous traitement écoulés avant que 25 % des patients présentent au moins une exacerbation de BPCO/hospitalisation pour exacerbation de BPCO. Dans l'étude A, 25 % des patients sous placebo ont présenté une exacerbation au jour 112 alors que 25 % des patients traités par Spiriva Respimat ont présenté une exacerbation au jour 173 (p = 0,09). Dans l'étude B, 25 % des patients sous placebo ont présenté une exacerbation au jour 74 alors que 25 % des patients traités par Spiriva Respimat ont présenté une exacerbation au jour 149 (p < 0,0001).
(2) Les risques relatifs ont été estimés avec un modèle aléatoire proportionnel de Cox. La réduction du risque exprimé en pourcentage est calculée avec la formule suivante : 100 (1 - risque relatif).
(3) Régression de Poisson. La réduction du risque est calculée avec la formule suivante : 100 (1 - rapport des taux).
(4) Le regroupement pour l'analyse des données était prévu initialement. Les paramètres mesurant les exacerbations ont été significativement améliorés dans l'analyse séparée des deux études de 1 an.
Dans une analyse rétrospective groupée des données issues des trois études contrôlées de 1 an et d'une étude de 6 mois conduites avec Spiriva Respimat versus placebo, ayant inclus 6096 patients, une augmentation des chiffres de mortalités toutes causes confondues a été observée chez les patients traités par Spiriva Respimat (n = 68 ; incidence : 2,64 cas pour 100 patients-années) par rapport au placebo (51 ; incidence : 1,98), correspondant à un ratio de 1,33 (IC à 95 % : 0,93 à 1,92) dans la période de traitement programmée ; l'excès de mortalité a été observé chez les patients présentant des antécédents connus de troubles du rythme cardiaque.
PHARMACOCINÉTIQUE |
- Généralités :
- Le bromure de tiotropium est un ammonium quaternaire non chiral peu soluble dans l'eau. Il est présenté sous forme de solution pour inhalation administrée par l'intermédiaire du dispositif d'inhalation Respimat. Approximativement 40 % de la dose inhalée est déposée dans les poumons, l'organe cible, le reste étant déposé dans le tractus gastro-intestinal. Certaines des données pharmacocinétiques indiquées ci-dessous ont été obtenues avec des doses supérieures à la posologie thérapeutique recommandée.
- Caractéristiques pharmacocinétiques générales de la substance active après l'administration de la spécialité :
-
- Absorption : après inhalation de la solution chez de jeunes volontaires sains, les données concernant l'excrétion urinaire suggèrent qu'approximativement 33 % de la dose inhalée atteint la circulation systémique. En raison de la structure chimique du produit (ammonium quaternaire) et compte tenu des résultats des expérimentations in vitro, l'absorption digestive attendue du bromure de tiotropium (10 à 15 %) est faible. La biodisponibilité absolue des solutions orales de bromure de tiotropium est de 2 à 3 %. À l'équilibre, les concentrations plasmatiques maximales de bromure de tiotropium chez les patients souffrant de BPCO ont été de 10,5 à 11,7 pg/ml, 10 minutes après l'administration d'une dose de 5 µg délivrée par l'inhalateur Respimat, pour diminuer rapidement selon un modèle à compartiments multiples. Les concentrations plasmatiques minimales à l'équilibre ont été de 1,49-1,68 pg/ml. La prise d'aliments n'est pas censée influer l'absorption de cet ammonium quaternaire.
- Distribution : la liaison du bromure de tiotropium aux protéines plasmatiques est de 72 % et son volume de distribution est de 32 l/kg. On ne connaît pas les concentrations locales pulmonaires, mais le mode d'administration laisse penser qu'elles sont beaucoup plus élevées. Les études chez le rat ont montré que le bromure de tiotropium ne traverse pas la barrière hémato-encéphalique de façon significative.
- Métabolisme : le métabolisme du bromure de tiotropium est faible. Chez des jeunes volontaires sains, l'excrétion urinaire de la substance non métabolisée atteint 74 % de la dose après une administration intraveineuse. L'ester du bromure de tiotropium est clivé, indépendamment d'un mécanisme enzymatique, en un dérivé alcool (N-méthylscopine) et un dérivé acide (acide dithiénylglycolique), inactifs sur les récepteurs muscariniques. Les études réalisées in vitro sur des microsomes hépatiques et des hépatocytes d'origine humaine montrent qu'une petite partie supplémentaire (< 20 % de la dose administrée par voie intraveineuse) est métabolisée par une réaction d'oxydation dépendante du cytochrome P450 (CYP) puis par conjugaison avec le glutathion, donnant naissance à une série de métabolites de phase II.
Les études in vitro effectuées sur des microsomes hépatiques suggèrent une inhibition du métabolisme par les inhibiteurs du CYP 2D6 (et 3A4), la quinidine, le kétoconazole et le gestodène. Les iso-enzymes CYP 2D6 et 3A4 sont donc impliquées pour une part dans le métabolisme. Il n'a pas été mis en évidence d'effet inhibiteur, même avec des concentrations élevées, sur les iso-enzymes CYP 1A1, 1A2, 2B6, 2C9, 2C19, 2D6, 2E1 ou 3A sur les microsomes hépatiques humains.
- Élimination : la demi-vie d'élimination terminale du bromure de tiotropium est comprise entre 5 et 6 jours après inhalation. La clairance totale a été de 880 ml/min après une dose intraveineuse chez de jeunes volontaires sains, avec une variabilité interindividuelle de 22 %. Le bromure de tiotropium administré par voie intraveineuse est essentiellement éliminé par voie urinaire sous forme inchangée (74 %). Après inhalation de la solution, l'excrétion urinaire est comprise entre 20,1 et 29,4 % de la dose, le reste étant principalement constitué de médicament non absorbé dans l'intestin puis éliminé dans les fèces. La clairance rénale du bromure de tiotropium est plus élevée que la clairance de la créatinine, reflétant une sécrétion urinaire.
- Linéarité/non-linéarité : le bromure de tiotropium montre des propriétés pharmacocinétiques linéaires dans l'intervalle thérapeutique après une administration intraveineuse, une inhalation de poudre sèche et une inhalation de la solution.
- Absorption : après inhalation de la solution chez de jeunes volontaires sains, les données concernant l'excrétion urinaire suggèrent qu'approximativement 33 % de la dose inhalée atteint la circulation systémique. En raison de la structure chimique du produit (ammonium quaternaire) et compte tenu des résultats des expérimentations in vitro, l'absorption digestive attendue du bromure de tiotropium (10 à 15 %) est faible. La biodisponibilité absolue des solutions orales de bromure de tiotropium est de 2 à 3 %. À l'équilibre, les concentrations plasmatiques maximales de bromure de tiotropium chez les patients souffrant de BPCO ont été de 10,5 à 11,7 pg/ml, 10 minutes après l'administration d'une dose de 5 µg délivrée par l'inhalateur Respimat, pour diminuer rapidement selon un modèle à compartiments multiples. Les concentrations plasmatiques minimales à l'équilibre ont été de 1,49-1,68 pg/ml. La prise d'aliments n'est pas censée influer l'absorption de cet ammonium quaternaire.
- Caractéristiques pharmacocinétiques dans des populations particulières :
-
- Sujet âgé : comme pour les médicaments excrétés majoritairement par voie rénale, la clairance rénale du bromure de tiotropium diminue avec l'âge (326 ml/min chez des sujets atteints de BPCO de moins de 58 ans contre 163 ml/min chez des patients atteints de BPCO de plus de 70 ans), ce qui peut s'expliquer par la diminution physiologique de la fonction rénale avec l'âge. Après inhalation, l'excrétion urinaire de bromure de tiotropium diminue de 14 % (jeunes volontaires sains) à environ 7 % chez des patients atteints de BPCO. Toutefois, les concentrations plasmatiques ne varient pas significativement en fonction de l'âge chez des patients atteints de BPCO, si on compare les variations inter et intra-individuelles (augmentation de 43 % de l'AUC0-4h après inhalation sous forme de poudre).
- Insuffisance rénale : comme avec tous les autres médicaments principalement excrétés par voie rénale, l'insuffisance rénale s'accompagne d'une augmentation des concentrations plasmatiques du médicament et d'une diminution de sa clairance rénale, tant après perfusion intraveineuse qu'après inhalation sous forme de poudre. L'existence d'une insuffisance rénale légère (CLcr 50-80 ml/min), souvent observée chez le sujet âgé, n'augmente que légèrement les concentrations plasmatiques de bromure de tiotropium (augmentation de 39 % de l'AUC0-4h après perfusion intraveineuse). Chez les patients atteints de BPCO et présentant une insuffisance rénale modérée à sévère (CLcr < 50 ml/min), les concentrations plasmatiques de bromure de tiotropium ont été doublées (augmentation de 82 % de l'AUC0-4h) après l'administration intraveineuse du médicament. Ce phénomène a été confirmé par la mesure des concentrations plasmatiques après inhalation sous forme de poudre mais également après une inhalation de solution par l'inhalateur Respimat.
- Insuffisance hépatique : il n'est pas attendu de modification significative de la pharmacocinétique du bromure de tiotropium en cas d'insuffisance hépatique, dans la mesure où le produit est essentiellement éliminé par voie rénale (74 % chez le jeune volontaire sain) et métabolisé par simple clivage non enzymatique des liaisons esters en produits pharmacologiquement inactifs.
- Pédiatrie : cf Posologie et Mode d'administration.
- Sujet âgé : comme pour les médicaments excrétés majoritairement par voie rénale, la clairance rénale du bromure de tiotropium diminue avec l'âge (326 ml/min chez des sujets atteints de BPCO de moins de 58 ans contre 163 ml/min chez des patients atteints de BPCO de plus de 70 ans), ce qui peut s'expliquer par la diminution physiologique de la fonction rénale avec l'âge. Après inhalation, l'excrétion urinaire de bromure de tiotropium diminue de 14 % (jeunes volontaires sains) à environ 7 % chez des patients atteints de BPCO. Toutefois, les concentrations plasmatiques ne varient pas significativement en fonction de l'âge chez des patients atteints de BPCO, si on compare les variations inter et intra-individuelles (augmentation de 43 % de l'AUC0-4h après inhalation sous forme de poudre).
- Relation(s) entre paramètres pharmacocinétiques et paramètres pharmacodynamiques :
- Il n'y a pas de relation directe entre les paramètres pharmacocinétiques et la pharmacodynamie du produit.
SÉCURITE PRÉCLINIQUE |
De nombreux effets observés dans les études conventionnelles de pharmacologie de sécurité, de toxicité en administration répétée et de toxicité des fonctions de reproduction peuvent s'expliquer par les propriétés anticholinergiques du bromure de tiotropium.
Chez l'animal, ont ainsi été observées une diminution de la consommation de nourriture, une réduction de la prise de poids, une sécheresse buccale et nasale, une réduction de la sécrétion de larmes et de salive, une mydriase et une augmentation du rythme cardiaque. D'autres effets notables ont été observés lors des études de toxicité en administration répétée : légère irritation du tractus respiratoire chez le rat et la souris, se manifestant par une rhinite et des altérations de l'épithélium de la cavité nasale et du larynx, et prostatite avec dépôts de substances de type protéinique et lithiases vésicales chez le rat.
Des effets délétères sur la gestation, le développement embryofoetal, la parturition ou le développement postnatal n'ont été observés qu'à des doses toxiques pour les mères.
Le bromure de tiotropium n'a pas induit d'effets tératogènes chez le rat et le lapin. Les effets sur l'appareil respiratoire (irritation) et urogénital (prostatite), ainsi que des effets délétères sur la reproduction ont été observés après administration locale ou systémique de doses cinq fois supérieures à la dose thérapeutique. Les études de génotoxicité et de carcinogenèse n'ont pas révélé de risque particulier pour l'espèce humaine.
MODALITÉS DE CONSERVATION |
- Durée de conservation :
- 3 ans.
Ne pas congeler.
- Après insertion de la cartouche dans l'inhalateur :
- 3 mois.
MODALITÉS MANIPULATION/ÉLIMINATION |
Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation locale en vigueur.
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| AMM | 3400938192032 (2007, RCP rév 12.11.2010). |
| Prix : | 40.76 euros (inhalateur + cartouche). |
| Remb Séc soc à 65 %. Collect. | |
BOEHRINGER INGELHEIM FRANCE
14, rue Jean-Antoine-de-Baïf. 75644 Paris cdx 13
Info médic et pharmacovigilance :
12, rue André-Huet. 51100 Reims
Info médic : Tél : 03 26 50 45 33
Pharmacovigilance : Tél : 03 26 50 47 70
