VOTRIENT®
pazopanib
FORMES et PRÉSENTATIONS |
Comprimé pelliculé à 400 mg (en forme de gélule avec « GS UHL » gravé sur l'un des côtés ; blanc) : Flacons de 30 et de 60, avec fermeture de sécurité enfant.
COMPOSITION |
| p cp | |
| Pazopanib (DCI) chlorhydrate exprimé en pazopanib | 200 mg |
| ou | 400 mg |
INDICATIONS |
POSOLOGIE ET MODE D'ADMINISTRATION |
Le traitement par Votrient doit être initié uniquement par un médecin expérimenté dans l'administration d'agents anticancéreux.
- Adulte :
- La dose de pazopanib recommandée est de 800 mg une fois par jour.
- Modifications de dose :
- La dose devra être ajustée par paliers de 200 mg en fonction de la tolérance individuelle au traitement afin de pouvoir gérer les effets indésirables. La dose de pazopanib ne devra pas excéder 800 mg.
- Population pédiatrique :
- L'utilisation du pazopanib n'est pas recommandée chez les enfants et adolescents de moins de 18 ans en raison de l'insuffisance de données de sécurité et d'efficacité.
- Sujet âgé :
- Les données concernant l'utilisation du pazopanib chez les patients âgés de 65 ans et plus sont limitées. Dans les études avec le pazopanib dans le RCC, globalement aucune différence cliniquement significative n'a été observée concernant la sécurité du pazopanib entre les sujets de plus de 65 ans et les plus jeunes. L'expérience clinique n'a pas mis en évidence de différence de réponses entre les patients âgés et les plus jeunes, cependant une plus grande sensibilité chez certains individus plus âgés ne peut être exclue.
- Insuffisance rénale :
- Il est peu probable qu'une insuffisance rénale ait un effet cliniquement significatif sur la pharmacocinétique du pazopanib au vu de la faible excrétion rénale du pazopanib et de ses métabolites (cf Pharmacocinétique). Par conséquent, aucun ajustement posologique n'est requis chez les patients ayant une clairance de la créatinine supérieure à 30 ml/min. Il est conseillé d'être prudent chez les patients ayant une clairance de la créatinine inférieure à 30 ml/min étant donné qu'aucune donnée n'est disponible avec le pazopanib dans cette population de patients.
- Insuffisance hépatique :
- La sécurité et la pharmacocinétique du pazopanib chez les patients ayant une insuffisance hépatique n'ont pas été complètement établis (cf Mises en garde et Précautions d'emploi). L'administration du pazopanib aux patients ayant une insuffisance hépatique légère ou modérée doit être considérée avec prudence et étroitement surveillée en raison de l'augmentation possible de l'imprégnation au médicament. Les données disponibles sont insuffisantes chez les patients présentant une insuffisance hépatique légère pour recommander un ajustement de la posologie. Une dose réduite de pazopanib à 200 mg une fois par jour est recommandée chez les patients présentant une insuffisance hépatique modérée (cf Pharmacocinétique).
- Le pazopanib est contre-indiqué chez les patients présentant une insuffisance hépatique sévère (cf Contre-indications).
Mode d'administration :
Le pazopanib doit être pris sans nourriture, au moins 1 heure avant ou 2 heures après un repas (cf Pharmacocinétique). Les comprimés pelliculés de Votrient doivent être pris entiers avec de l'eau et non cassés ou écrasés (cf Pharmacocinétique).
CONTRE-INDICATIONS |
- Hypersensibilité à la substance active ou à l'un des excipients.
- Insuffisance hépatique sévère.
MISES EN GARDE et PRÉCAUTIONS D'EMPLOI |
- Effets hépatiques :
- Des cas d'insuffisance hépatique (incluant des décès) ont été rapportés au cours de l'utilisation du pazopanib. La sécurité et la pharmacocinétique du pazopanib n'ont pas été complètement établies chez les patients présentant une insuffisance hépatique pré-existante. L'administration du pazopanib aux patients présentant une insuffisance hépatique légère à modérée doit être envisagée avec prudence et étroitement surveillée. Une dose réduite de pazopanib à 200 mg une fois par jour est recommandée chez les patients présentant une insuffisance hépatique modérée (cf Posologie et Mode d'administration). Les données disponibles sont insuffisantes chez les patients présentant une insuffisance hépatique légère pour recommander un ajustement de la posologie. Le pazopanib est contre-indiqué chez les patients présentant une insuffisance hépatique sévère (cf Contre-indications).
- Dans les études cliniques avec le pazopanib, des augmentations des transaminases sériques (ALAT, ASAT) et de la bilirubine ont été observées (cf Effets indésirables). Dans la majorité des cas, des augmentations isolées des ALAT et des ASAT ont été rapportées, sans élévation concomitante des phosphatases alcalines ou de la bilirubine.
- Les tests hépatiques sériques seront contrôlés avant l'instauration du traitement par pazopanib et au moins une fois toutes les 4 semaines pendant les 4 premiers mois de traitement, et en fonction de l'état clinique du patient. Il conviendra de continuer une surveillance périodique après ce délai.
-
- Les patients ayant une élévation isolée des transaminases <= 8 fois la limite supérieure de la normale (LSN) peuvent continuer le traitement par pazopanib avec une surveillance hebdomadaire de la fonction hépatique jusqu'à ce que le taux de transaminases revienne au grade 1 ou à l'état initial.
- Les patients ayant des transaminases > 8 fois la LSN doivent arrêter le traitement par pazopanib jusqu'à ce que leur taux revienne au grade 1 ou à l'état initial. Si les bénéfices attendus de la reprise du traitement par pazopanib l'emportent sur le risque potentiel d'hépatotoxicité, il est alors possible de réintroduire le pazopanib à une dose réduite en réalisant des bilans hépatiques hebdomadaires pendant 8 semaines (cf Posologie et Mode d'administration). Après la réintroduction du pazopanib, si les transaminases s'élèvent à nouveau à plus de 3 fois la LSN, il faudra alors arrêter le traitement par pazopanib.
- Si une élévation des transaminases > 3 fois la LSN survient simultanément à une élévation de la bilirubine > 2 fois la LSN, un dosage des différentes fractions de la bilirubine devra être réalisé. Si la bilirubine directe (conjuguée) est supérieure à 35 % de la bilirubine totale, il faudra alors arrêter le traitement par pazopanib.
- Les patients ayant une élévation isolée des transaminases <= 8 fois la limite supérieure de la normale (LSN) peuvent continuer le traitement par pazopanib avec une surveillance hebdomadaire de la fonction hépatique jusqu'à ce que le taux de transaminases revienne au grade 1 ou à l'état initial.
- Hypertension artérielle :
- Des événements liés à l'hypertension artérielle, incluant des épisodes symptomatiques nouvellement diagnostiqués de pression artérielle élevée (crises hypertensives), sont survenus dans les essais cliniques avec pazopanib.
- La pression artérielle devra être bien contrôlée préalablement à l'initiation du traitement par pazopanib. L'hypertension doit être dépistée et traitée si nécessaire avec des traitements antihypertenseurs standards (cf Effets indésirables). Des valeurs élevées de pression artérielle (pression artérielle systolique >= 150 ou pression artérielle diastolique >= 100 mmHg) ont été rapportées en début de traitement (39 % des cas sont survenus avant le 9e jour de traitement et 88 % des cas sont survenus dans les 18 premières semaines). En cas d'hypertension persistante malgré le traitement antihypertenseur, la dose de pazopanib peut être réduite (cf Posologie et Mode d'administration). Le traitement par pazopanib doit être arrêté en cas de valeurs élevées et persistantes de la pression artérielle (140/90 mmHg) ou en cas d'hypertension artérielle sévère et persistante malgré le traitement antihypertenseur et la réduction de la dose de pazopanib.
- Allongement de l'intervalle QT et torsade de pointes :
- Dans les études cliniques avec le pazopanib, des événements correspondant à un allongement de l'intervalle QT et des torsade de pointes sont survenus (cf Effets indésirables). Le pazopanib devra être utilisé avec précaution chez les patients ayant des antécédents d'allongement de l'intervalle QT, chez les patients prenant des anti-aryhtmiques ou d'autres médicaments pouvant allonger l'intervalle QT et chez les patients ayant une maladie cardiaque pré-existante significative. Sous pazopanib, la surveillance par des électrocardiogrammes avant traitement et régulièrement, et le maintien des électrolytes (par exemple, calcium, magnésium, potassium) dans les valeurs normales sont recommandés.
- Événements thrombotiques artériels :
- Dans les études cliniques avec le pazopanib, infarctus du myocarde, accident ischémique et accident ischémique transitoire ont été observés (cf Effets indésirables). Le pazopanib devra être utilisé avec précaution chez les patients ayant un risque accru de présenter ces événements. La décision de traiter devra être prise sur la base de l'évaluation du rapport bénéfice/risque individuel du patient.
- Événements hémorragiques :
- Dans les études cliniques avec le pazopanib, des événements hémorragiques ont été rapportés (cf Effets indésirables). L'utilisation du pazopanib n'est pas recommandée chez les patients ayant des antécédents d'hémoptysie, d'hémorragie cérébrale, ou d'hémorragie gastro-intestinale (GI) cliniquement significative survenus dans les 6 derniers mois. Le pazopanib devra être utilisé avec précaution chez les patients ayant des risques significatifs d'hémorragie.
- Perforations et fistules gastro-intestinales :
- Dans les études cliniques avec le pazopanib, des événements correspondant à une perforation ou une fistule gastro-intestinales sont survenus (cf Effets indésirables). Le pazopanib devra être utilisé avec précaution chez les patients à risque de perforation ou de fistule gastro-intestinales.
- Cicatrisation des plaies :
- Aucune étude spécifique concernant l'effet du pazopanib sur la cicatrisation des plaies n'a été menée. Étant donné que les inhibiteurs du facteur de croissance endothélial vasculaire (VEGF) peuvent altérer la cicatrisation des plaies, le traitement par pazopanib devra être arrêté au moins 7 jours avant une intervention chirurgicale planifiée. La décision de reprendre le traitement par pazopanib après une intervention chirurgicale devra reposer sur le constat clinique d'une cicatrisation appropriée des plaies. Le traitement par pazopanib devra être arrêté en cas de désunion des sutures de la plaie.
- Insuffisance cardiaque :
- La sécurité et la pharmacocinétique du pazopanib n'ont pas été étudiées chez les patients présentant une insuffisance cardiaque modérée à sévère.
- Hypothyroïdie :
- Dans les études cliniques avec le pazopanib, des événements correspondant à une hypothyroïdie sont survenus (cf Effets indésirables). Des dosages biologiques de la fonction thyroïdienne sont recommandés préalablement au traitement par pazopanib et les patients atteints d'hypothyroïdie devront être traités conformément à la pratique médicale standard. Les signes et symptômes d'une dysfonction thyroïdienne devront être étroitement surveillés chez tous les patients traités par le pazopanib. Une surveillance biologique de la fonction thyroïdienne devra être réalisée périodiquement et toute anomalie sera prise en charge conformément à la pratique médicale standard.
- Protéinurie :
- Dans les études cliniques avec le pazopanib, des cas de protéinurie ont été rapportés. Il est recommandé de réaliser une analyse urinaire avant l'initiation du traitement et périodiquement pendant le traitement, et de surveiller l'aggravation d'une protéinurie.
- Le traitement par pazopanib devra être arrêté si le patient développe une protéinurie de grade 4.
- Grossesse :
- Les études précliniques chez l'animal ont mis en évidence une toxicité sur la reproduction (cf Sécurité préclinique). Si le pazopanib est utilisé pendant la grossesse, ou si la patiente devient enceinte en cours de traitement par pazopanib, elle devra être avertie des risques potentiels pour le foetus. Il est conseillé aux femmes en âge de procréer d'éviter de débuter une grossesse pendant le traitement par pazopanib (cf Fertilité/Grossesse/Allaitement).
- Interactions :
-
- L'administration concomitante avec des inhibiteurs puissants du CYP 3A4, de la glycoprotéine P (P-gp) ou de la protéine de résistance au cancer du sein (BCRP) doit être évitée en raison du risque d'augmentation de l'imprégnation en pazopanib (cf Interactions). L'utilisation d'un autre traitement pris de façon concomitante et présentant un potentiel inhibiteur minimal ou nul du CYP 3A4, de la P-gp ou de la BCRP devra être envisagée.
- L'administration concomitante avec des inducteurs du CYP 3A4 doit être évitée en raison du risque de diminution de l'imprégnation en pazopanib (cf Interactions).
- L'administration concomitante de pazopanib avec des substrats de l'uridine diphosphate glucuronosyl transférase 1A1 (UGT1A1) [par exemple, irinotécan] doit être envisagée avec précaution étant donné que le pazopanib est un inhibiteur de l'UGT1A1.
- Le jus de pamplemousse devra être évité pendant le traitement par pazopanib (cf Interactions).
- L'administration concomitante avec des inhibiteurs puissants du CYP 3A4, de la glycoprotéine P (P-gp) ou de la protéine de résistance au cancer du sein (BCRP) doit être évitée en raison du risque d'augmentation de l'imprégnation en pazopanib (cf Interactions). L'utilisation d'un autre traitement pris de façon concomitante et présentant un potentiel inhibiteur minimal ou nul du CYP 3A4, de la P-gp ou de la BCRP devra être envisagée.
INTERACTIONS |
- Effets des autres médicaments sur le pazopanib :
- Les études in vitro suggèrent que le métabolisme oxydatif du pazopanib dans les microsomes hépatiques humains est médié principalement par le CYP 3A4, avec des contributions mineures des CYP 1A2 et CYP 2C8. Par conséquent, les inhibiteurs et les inducteurs du CYP 3A4 peuvent altérer le métabolisme du pazopanib.
-
- Inhibiteurs CYP 3A4, P-gp, BCRP :
- Le pazopanib est un substrat pour CYP 3A4, P-gp et BCRP.
- L'administration concomitante du pazopanib avec des inhibiteurs puissants de la famille du CYP 3A4 (par exemple, kétoconazole, itraconazole, clarithromycine, atazanavir, indinavir, néfazodone, nelfinavir, ritonavir, saquinavir, télithromycine, voriconazole) peut augmenter les concentrations de pazopanib. Le jus de pamplemousse contient un inhibiteur du CYP 3A4 et peut également augmenter les concentrations plasmatiques de pazopanib.
- L'administration de 1500 mg de lapatinib (substrat et faible inhibiteur du CYP 3A4 et de la P-gp et puissant inhibiteur de la BCRP) avec 800 mg de pazopanib a entraîné une augmentation approximative de 50 à 60 % de l'ASC(0-24) et de la Cmax moyenne du pazopanib par rapport à l'administration de 800 mg de pazopanib seul. L'inhibition de la P-gp et/ou de la BCRP par le lapatinib a probablement contribué à l'augmentation de l'imprégnation en pazopanib.
- L'administration concomitante d'une dose unique de pazopanib en collyre (à la faible dose de 400 µg [80 µl à 5 mg/ml]) et de kétoconazole, inhibiteur puissant du CYP 3A4 et inhibiteur de la P-gp, chez des volontaires sains a entraîné une augmentation des valeurs moyennes d'ASC(0-t) et de Cmax, respectivement d'un facteur 2,2 et d'un facteur 1,5. L'inhibition de la P-gp et/ou de la BCRP par le kétoconazole a probablement contribué à l'augmentation de l'imprégnation en pazopanib. A ce jour, aucun schéma posologique ne peut être recommandé ni pour les inhibiteurs spécifiques puissants du CYP 3A4, ni pour le kétoconazole.
- L'administration concomitante du pazopanib et d'un inhibiteur du CYP 3A4, de la P-gp et de la BCRP, tel que le lapatinib, entraînera une augmentation des concentrations plasmatiques de pazopanib. L'administration concomitante avec des inhibiteurs puissants de la P-gp ou de la BCRP peut également altérer l'imprégnation et la distribution du pazopanib, incluant la distribution dans le système nerveux central (SNC).
- L'association aux inhibiteurs puissants du CYP 3A4, de la P-gp et de la BCRP devra donc être évitée, ou l'utilisation d'un autre traitement pris de façon concomitante et présentant un potentiel inhibiteur minimal ou nul du CYP 3A4, de la P-gp ou de la BCRP est recommandée.
-
- Inducteurs CYP 3A4, P-gp, BCRP :
- Les inducteurs du CYP 3A4 comme la rifampicine peuvent diminuer les concentrations plasmatiques de pazopanib. L'administration concomitante de pazopanib et d'inducteurs puissants de la P-gp ou de la BCRP peuvent altérer l'imprégnation et la distribution du pazopanib, incluant la distribution dans le SNC. L'utilisation d'un autre traitement pris de façon concomitante et ne présentant pas ou peu d'effet inducteur d'enzyme ou de transporteur est recommandé.
- Effets du pazopanib sur les autres médicaments :
- Les études in vitro avec des microsomes hépatiques humains ont montré que le pazopanib inhibait les enzymes CYP 1A2, 3A4, 2B6, 2C8, 2C9, 2C19, et 2E1. L'induction potentielle du CYP 3A4 humain a été démontrée lors d'études in vitro du récepteur PXR humain (récepteur nucléaire X des prégnanes). Les études de pharmacologie clinique, utilisant 800 mg de pazopanib une fois par jour, ont montré que le pazopanib n'a pas d'effet cliniquement significatif sur la pharmacocinétique de la caféine (substrat de test du CYP 1A2), de la warfarine (substrat de test du CYP 2C9), ou de l'oméprazole (substrat de test du CYP 2C19) chez les patients atteints de cancer. L'administration de pazopanib a entraîné une augmentation de 30 % environ de l'ASC moyenne et de la Cmax du midazolam (substrat de test du CYP 3A4) et une augmentation de 33 à 64 % du rapport des concentrations urinaires du dextrométhorphane/dextrophan après administration par voie orale de dextrométhorphane (substrat de test du CYP 2D6). L'administration concomitante de 800 mg de pazopanib une fois par jour et de 80 mg/m2 de paclitaxel (substrat du CYP 3A4 et du CYP 2C8) une fois par semaine a entraîné une augmentation moyenne de l'ASC et de la Cmax du paclitaxel, respectivement de 25 et 31 %.
- Sur la base des valeurs de l'IC50 in vitro et de la Cmax plasmatique in vivo, il a été mis en évidence que les métabolites GSK1268992 et GSK1268997 du pazopanib peuvent contribuer à l'effet inhibiteur net du pazopanib vis-à-vis de la BCRP. De plus, l'inhibition de la BCRP et de la P-gp par le pazopanib dans le tractus gastro-intestinal ne peut être exclue. Une attention particulière doit être portée lors de l'administration du pazopanib de façon concomitante avec des substrats oraux de la BCRP et de la P-gp.
- In vitro, le pazopanib inhibait le polypeptide de transport d'anion organique humain (OATP1B1). Il ne peut être exclu que le pazopanib affectera la pharmacocinétique des substrats de l'OATP1B1 [par exemple, rosuvastatine].
- Effet de la nourriture sur le pazopanib :
- L'administration de pazopanib avec un repas riche ou pauvre en matières grasses a entraîné une augmentation de l'ASC et de la Cmax d'un facteur 2 environ. Par conséquent, le pazopanib devra être administré au moins 1 heure avant ou 2 heures après un repas.
FERTILITÉ/GROSSESSE/ALLAITEMENT |
Il n'existe pas de données pertinentes concernant l'utilisation du pazopanib chez la femme enceinte. Les études effectuées chez l'animal ont mis en évidence une toxicité sur la reproduction (cf Sécurité préclinique). Le risque potentiel dans l'espèce humaine n'est pas connu.
Le pazopanib ne devra pas être utilisé pendant la grossesse à moins que l'état clinique de la patiente ne nécessite un traitement par pazopanib. Si le pazopanib est utilisé pendant la grossesse, ou si la patiente devient enceinte en cours de traitement par pazopanib, elle devra être avertie des risques potentiels pour le foetus.
Il est recommandé aux femmes en âge de procréer d'avoir recours à une méthode efficace de contraception et d'éviter de débuter une grossesse pendant le traitement par pazopanib.
Allaitement :
L'innocuité du pazopanib pendant l'allaitement n'a pas été établi. Aucune donnée sur le passage du pazopanib dans le lait maternel n'est disponible. Il n'existe pas de donnée chez l'animal sur l'excrétion du pazopanib dans le lait animal. Un risque pour les nouveau-nés/nourrissons ne peut être exclu. L'allaitement doit être interrompu au cours du traitement par pazopanib.
Fécondité :Les études effectuées chez l'animal ont montré que la fécondité mâle et femelle peut être affectée par un traitement par pazopanib (cf Sécurité préclinique).
CONDUITE et UTILISATION DE MACHINES |
EFFETS INDÉSIRABLES |
Des effets indésirables graves ont été rapportés chez moins de 1 % des patients traités : accident ischémique transitoire, accident vasculaire cérébral ischémique, ischémie myocardique, troubles de la fonction cardiaque, perforation et fistule gastro-intestinales, allongement de l'intervalle QT et hémorragies pulmonaire, gastro-intestinale et cérébrale.
Les événements d'issue fatale considérés comme possiblement liés au pazopanib, incluaient hémorragie gastro-intestinale, hémorragie pulmonaire/hémoptysie, fonction hépatique anormale, perforation intestinale et accident vasculaire cérébral ischémique.
Les effets indésirables les plus fréquents (survenus chez au moins 10 % des patients) et de tout grade ont notamment été : diarrhée, modification de la couleur des cheveux, hypertension, nausées, fatigue, anorexie, vomissement, dysgueusie, élévation de l'alanine aminotransférase et élévation de l'aspartate aminotransférase.
Les effets indésirables liés au traitement, de tout grade, qui ont été rapportés chez les patients atteints de RCC sont listés ci-dessous, classés par organe, par fréquence et par grade de sévérité (classification MedDRA). La convention suivante a été utilisée pour la classification des fréquences : très fréquent (>= 1/10), fréquent (>= 1/100, < 1/10), peu fréquent (>= 1/1000, < 1/100), rare (>= 1/10 000, < 1/1000), très rare (< 1/10 000), indéterminée (ne peut être estimée sur la base des données disponibles).
Des catégories ont été définies sur la base des fréquences absolues issues des données des études cliniques. Pour chaque groupe d'événements, les effets indésirables sont présentés suivant un ordre décroissant de fréquence.
| Système classe organe
Fréquence (tous grades) : - Effets indésirables | Tous grades n (%) | Grade 3 n (%) | Grade 4 n (%) |
| Affections hématologiques et du système lymphatique : | |||
| Fréquent : | |||
| - Thrombocytopénie | 25 (4 %) | 3 (< 1 %) | 3 (< 1 %) |
| - Neutropénie | 17 (3 %) | 4 (< 1 %) | 2 (< 1 %) |
| - Leucopénie | 14 (2 %) | 1 (< 1 %) | 0 |
| Affections endocriniennes : | |||
| Fréquent : | |||
| - Hypothyroïdie | 23 (4 %) | 0 | 0 |
| Troubles du métabolisme et de la nutrition : | |||
| Très fréquent : | |||
| - Diminution de l'appétit(a)
| 122 (21 %) | 6 (1 %) | 0 |
| Peu fréquent : | |||
| - Hypophosphatémie | 4 (< 1 %) | 2 (< 1 %) | 0 |
| - Hypomagnésémie | 3 (< 1 %) | 0 | 0 |
| Affections du système nerveux : | |||
| Très fréquent : | |||
| - Dysgueusie(b)
| 92 (16 %) | 0 | 0 |
| Fréquent : | |||
| - Maux de tête | 41 (7 %) | 0 | 0 |
| - Sensation vertigineuse | 19 (3 %) | 0 | 1 (< 1 %) |
| - Léthargie | 12 (2 %) | 1 (< 1 %) | 0 |
| - Paresthésie | 12 (2 %) | 2 (< 1 %) | 0 |
| Peu fréquent : | |||
| - Neuropathie périphérique sensitive | 5 (< 1 %) | 0 | 0 |
| - Hypoesthésie | 4 (< 1 %) | 0 | 0 |
| - Accident ischémique transitoire | 3 (< 1 %) | 2 (< 1 %) | 0 |
| - Accident vasculaire cérébral | 1 (< 1 %) | 0 | 1 (< 1 %) |
| - Accident vasculaire cérébral ischémique | 1 (< 1 %) | 0 | 0 |
| Affections oculaires : | |||
| Peu fréquent : | |||
| - Décoloration des cils | 3 (< 1 %) | 0 | 0 |
| Affections cardiaques : | |||
| Peu fréquent : | |||
| - Bradycardie | 3 (< 1 %) | 0 | 0 |
| - Troubles de la fonction cardiaque | 4 (< 1 %) | 1 (< 1 %) | 1 (< 1 %) |
| - Infarctus du myocarde | 2 (< 1 %) | 0 | 2 (< 1 %) |
| - Ischémie myocardique | 1 (< 1 %) | 1 (< 1 %) | 0 |
| Affections vasculaires : | |||
| Très fréquent : | |||
| - Hypertension | 225 (38 %) | 34 (6%) | 0 |
| Fréquent : | |||
| - Bouffées de chaleur | 11 (2 %) | 0 | 0 |
| Peu fréquent : | |||
| - Bouffées vasomotrices | 5 (< 1 %) | 0 | 0 |
| - Hémorragie | 1 (< 1 %) | 0 | 0 |
| - Crise hypertensive | 1 (< 1 %) | 0 | 1 (< 1 %) |
| Affections respiratoires, thoraciques et médiastinales : | |||
| Fréquent : | |||
| - Épistaxis | 16 (3 %) | 0 | 0 |
| - Dysphonie | 15 (3 %) | 0 | 0 |
| Peu fréquent : | |||
| - Embolie pulmonaire | 4 (< 1 %) | 1 (< 1 %) | 3 (< 1 %) |
| - Hémoptysie | 3 (< 1 %) | 0 | 0 |
| - Hémorragie pulmonaire | 1 (< 1 %) | 0 | 0 |
| Affections gastro-intestinales : | |||
| Très fréquent : | |||
| - Diarrhée | 286 (49 %) | 19 (3 %) | 2 (< 1 %) |
| - Nausées | 161 (27 %) | 3 (< 1 %) | 0 |
| - Vomissements | 89 (15 %) | 7 (1 %) | 1 (< 1 %) |
| - Douleur abdominale(c)
| 60 (10 %) | 8 (1 %) | 0 |
| Fréquent : | |||
| - Dyspepsie | 24 (4 %) | 2 (< 1 %) | 0 |
| - Stomatite | 24 (4 %) | 0 | 0 |
| - Flatulences | 20 (3 %) | 0 | 0 |
| - Distension abdominale | 15 (3 %) | 0 | 0 |
| Peu fréquent : | |||
| - Ulcération buccale | 4 (< 1 %) | 1 (< 1 %) | 0 |
| - Selles fréquentes | 3 (< 1 %) | 0 | 0 |
| - Hémorragie gastro-intestinale | 3 (< 1 %) | 1 (< 1 %) | 0 |
| - Hémorragie rectale | 3 (< 1 %) | 1 (< 1 %) | 0 |
| - Perforation colique | 2 (< 1 %) | 1 (< 1 %) | |
| - Hémorragie buccale | 2 (< 1 %) | 0 | 0 |
| - Fistule entérocutanée | 1 (< 1 %) | 0 | 0 |
| - Hématémèse | 1 (< 1 %) | 0 | 0 |
| - Selles sanglantes | 1 (< 1 %) | 0 | 0 |
| - Hémorragie hémorroïdaire | 1 (< 1 %) | 0 | 0 |
| - Perforation de l'iléus | 1 (< 1 %) | 0 | 1 (< 1 %) |
| - Méléna | 1 (< 1 %) | 0 | 0 |
| - Hémorragie de l'oesophage | 1 (< 1 %) | 0 | 1 (< 1 %) |
| - Pancréatite | 1 (< 1 %) | 0 | 0 |
| - Péritonite | 1 (< 1 %) | 0 | 0 |
| - Hémorragie rétropéritonéale | 1 (< 1 %) | 0 | 0 |
| - Hémorragie du tractus digestif supérieur | 1 (< 1 %) | 0 | 0 |
| Affections hépatobiliaires : | |||
| Fréquent : | |||
| - Fonction hépatique anormale | 20 (3 %) | 6 (1 %) | 0 |
| - Hyperbilirubinémie | 18 (3 %) | 2 (< 1 %) | 1 (< 1 %) |
| Peu fréquent : | |||
| - Hépatotoxicité | 5 (< 1 %) | 3 (< 1 %) | 0 |
| - Ictère | 2 (< 1 %) | 1 (< 1 %) | 0 |
| - Insuffisance hépatique | 1 (< 1 %) | 0 | 1 (< 1 %) |
| - Hépatite | 1 (< 1 %) | 1 (< 1 %) | 0 |
| Affections de la peau et du tissu sous-cutané : | |||
| Très fréquent : | |||
| - Modification de la couleur des cheveux | 231 (39 %) | 1 (< 1 %) | 0 |
| Fréquent : | |||
| - Rash | 52 (9 %) | 3 (< 1 %) | 0 |
| - Alopécie | 50 (9 %) | 0 | 0 |
| - Érythrodysesthésie palmo-plantaire (syndrome main-pied) | 43 (7 %) | 7 (1 %) | 0 |
| - Hypopigmentation de la peau | 25 (4 %) | 0 | 0 |
| - Érythème | 15 (3 %) | 0 | 0 |
| - Prurit | 13 (2 %) | 0 | 0 |
| - Dépigmentation de la peau | 13 (2 %) | 0 | 0 |
| - Sécheresse cutanée | 12 (2 %) | 0 | 0 |
| - Hyperhidrose | 9 (2 %) | 0 | 0 |
| Peu fréquent : | |||
| - Réaction de photosensibilité | 7 (1 %) | 0 | 0 |
| - Exfoliation cutanée | 7 (1 %) | 0 | 0 |
| - Rash vésiculaire | 3 (< 1 %) | 0 | 0 |
| - Prurit généralisé | 2 (< 1 %) | 1 (< 1 %) | 0 |
| - Rash papulaire | 2 (< 1 %) | 0 | 0 |
| - Érythème plantaire | 1 (< 1 %) | 0 | 0 |
| - Rash érythémateux | 1 (< 1 %) | 0 | 0 |
| - Rash généralisé | 1 (< 1 %) | 0 | 0 |
| - Rash maculaire | 1 (< 1 %) | 0 | 0 |
| - Rash prurigineux | 1 (< 1 %) | 0 | 0 |
| Affections musculosquelettiques et systémiques : | |||
| Fréquent : | |||
| - Myalgie | 15 (3 %) | 2 (< 1 %) | 0 |
| - Spasmes musculaires | 12 (2 %) | 0 | 0 |
| Affections du rein et des voies urinaires : | |||
| Fréquent : | |||
| - Protéinurie | 40 (7 %) | 5 (< 1 %) | 0 |
| Peu fréquent : | |||
| - Hémorragie du tractus urinaire | 1 (< 1 %) | 0 | 0 |
| Affections des organes de reproduction et du sein : | |||
| Peu fréquent : | |||
| - Ménorragie | 1 (< 1 %) | 0 | 0 |
| - Métrorragie | 1 (< 1 %) | 0 | 0 |
| - Hémorragie vaginale | 1 (< 1 %) | 0 | 0 |
| Troubles généraux et anomalies au site d'administration : | |||
| Très fréquent : | |||
| - Fatigue | 139 (24 %) | 16 (3 %) | 0 |
| Fréquent : | |||
| - Asthénie | 41 (7 %) | 8 (1 %) | 0 |
| - Inflammation des muqueuses | 27 (5 %) | 2 (< 1 %) | 0 |
| - OEdème(d)
| 19 (3 %) | 0 | 0 |
| - Douleur thoracique | 14 (2 %) | 2 (< 1 %) | 0 |
| Peu fréquent : | |||
| - Lésions des muqueuses | 1 (< 1 %) | 0 | 0 |
| Investigations : | |||
| Très fréquent : | |||
| - Élévation de l'alanine aminotransférase | 83 (14%) | 28 (5 %) | 4 (< 1 %) |
| - Élévation de l'aspartate aminotransférase | 72 (12%) | 17 (3 %) | 3 (< 1 %) |
| Fréquent : | |||
| - Perte de poids | 38 (6 %) | 2 (< 1 %) | 0 |
| - Élévation de la créatininémie | 13 (2 %) | 2 (< 1 %) | 0 |
| - Élévation de la bilirubinémie | 11 (2 %) | 1 (< 1 %) | 1 (< 1 %) |
| - Diminution du nombre de globules blancs(e)
| 10 (2 %) | 1 (< 1 %) | 0 |
| - Élévation de la lipase | 9 (2 %) | 4 (< 1 %) | 1 (< 1 %) |
| - Augmentation de la pression artérielle | 6 (1 %) | 0 | 0 |
| - Élévation de l'hormone thyréotrope | 6 (1 %) | 0 | 0 |
| - Élévation de la gammaglutamyltransférase | 6 (1 %) | 1 (< 1 %) | 1 (< 1 %) |
| - Élévation des enzymes hépatiques | 6 (1 %) | 2 (< 1 %) | 0 |
| Peu fréquent : | |||
| - Aspartate aminotransférase | 5 (< 1 %) | 2 (< 1 %) | 0 |
| - Élévation de l'urémie | 5 (< 1 %) | 1 (< 1 %) | 0 |
| - Allongement de l'intervalle QT à l'électrocardiogramme | 5 (< 1 %) | 1 (< 1 %) | 0 |
| - Élévation de l'amylasémie | 4 (< 1 %) | 0 | 0 |
| - Diminution de la glycémie | 4 (< 1 %) | 0 | 0 |
| - Alanine aminotransférase | 3 (< 1 %) | 2 (< 1 %) | 0 |
| - Élévation des transaminases | 3 (< 1 %) | 1 (< 1 %) | 0 |
| - Augmentation de la pression artérielle diastolique | 2 (< 1 %) | 0 | 0 |
| - Dosage anormal de la fonction thyroïdienne | 2 (< 1 %) | 0 | 0 |
| - Augmentation de la pression artérielle systolique | 1 (< 1 %) | 0 | 0 |
| - Fonction hépatique anormale | 1 (< 1 %) | 0 | 0 |
(b) Dysgueusie, agueusie et hypogueusie.
(c) Douleur abdominale, douleur abdominale haute et douleur abdominale basse
(d) OEdème, oedème périphérique, oedème oculaire, oedème localisé et oedème de la face.
(e) Diminution du nombre de globules blancs, diminution du nombre de neutrophiles et diminution du nombre de leucocytes.
SURDOSAGE |
Il n'existe pas d'antidote spécifique à un surdosage par pazopanib, le traitement devra être symptomatique.
PHARMACODYNAMIE |
Classe pharmacothérapeutique : agents antinéoplasiques, inhibiteurs de protéine kinase (code ATC : L01XE11).
- Mécanisme d'action :
- Le pazopanib est un inhibiteur de protéine tyrosine-kinase puissant, administré par voie orale, visant plusieurs cibles : des récepteurs du facteur de croissance endothélial vasculaire (VEGFR1, VEGFR2, et VEGFR3), des récepteurs du facteur de croissance plaquettaire (PDGFRalpha et PDGFRß) et le récepteur du facteur de cellule souche (c-KIT) avec des valeurs de CI50 de 10, 30, 47, 71, 84 et 74 nM, respectivement. Au cours des expérimentations précliniques, le pazopanib a inhibé, de façon dose-dépendante, l'autophosphorylation induite par la liaison avec leurs ligands, des récepteurs du VEGFR2, du c-KIT et du PDGFRß dans les cellules. In vivo, le pazopanib a inhibé la phosphorylation du VEGFR2 induite par le VEGF dans les poumons de souris, l'angiogenèse de plusieurs modèles animaux et la croissance de multiples greffes tumorales humaines chez la souris.
- Études cliniques :
- La sécurité et l'efficacité du pazopanib dans le cancer du rein a été évaluée au cours d'une étude multicentrique, randomisée, en double-aveugle, contrôlée versus placebo. Les patients atteints d'un cancer du rein avancé et/ou métastatique (N = 435) ont été randomisés pour recevoir 800 mg de pazopanib une fois par jour ou du placebo. L'objectif principal de l'étude était d'évaluer et de comparer la survie sans progression (PFS) dans les 2 bras de traitements et le critère d'efficacité secondaire majeur était la survie globale (OS). Les autres objectifs étaient d'évaluer le taux de réponse globale et la durée de la réponse.
- Au total sur les 435 patients de l'étude, 233 patients n'avaient préalablement reçu aucun traitement et 202 étaient des patients de 2e ligne ayant préalablement reçu un traitement à base d'interleukine-2 ou d'interféron alpha. L'indice de performance (ECOG) était similaire entre les groupes pazopanib et placebo (ECOG 0 : 42 % vs 41 %, ECOG 1 : 58 % vs 59 %). La majorité des patients avait des facteurs pronostiques de Motzer/MSKCC (Memorial Sloan Kettering Cancer Centre) soit favorables (39 %), soit intermédiaires (54 %). Tous les patients avaient un cancer du rein de type histologique à cellules claires ou à prédominance de cellules claires. Près de la moitié des patients avaient 3 organes ou plus atteints et la plupart des patients avaient, à l'inclusion, des métastases pulmonaires (74 %) et/ou ganglionnaires (54 %).
- Le nombre de patients non préalablement traités et prétraités par des cytokines était équivalent dans chaque bras de traitement (53 % et 47 % dans le bras pazopanib, 54 % et 46 % dans le bras placebo). Dans le sous-groupe des patients prétraités par des cytokines, la majorité (75 %) avait reçu un traitement à base d'interféron.
- Un pourcentage similaire de patients, dans chaque bras de traitement, a subi préalablement une néphrectomie (89 % et 88 % dans les bras pazopanib et placebo, respectivement) et/ou a reçu préalablement une radiothérapie (22 % et 15 % dans les bras pazopanib et placebo, respectivement).
- L'analyse principale du critère d'évaluation primaire d'efficacité (PFS) était basée sur l'évaluation de la maladie par une revue radiologique indépendante dans la totalité de la population de l'étude (patients non prétraités et prétraités par des cytokines).
-
Tableau 2 : Résultats d'efficacité globale par une évaluation indépendante Critères d'évaluation/
Population de l'étudePazopanib Placebo RR (IC à 95 %) Valeur de p (unilatéral) PFS : - Population en ITT global*
N = 290 N = 145 - Médiane (mois)
9,2 4,2 0,46 (0,34 - 0,62) < 1 x 10-7 Taux de réponse N = 290 N = 145 % (IC à 95 %) 30 (25,1 - 35,6) 3 (0,5 - 6,4) - < 1 x 10-3 - RR = risque relatif ; ITT = intention de traiter ; PFS = survie sans progression.
-
*
Populations de patients non préalablement traités et prétraités par des cytokines.
-
Figure 1 : Courbe de Kaplan-Meier de la survie sans progression selon une évaluation indépendante dans la population globale (populations de patients non préalablement traités et prétraités par des cytokines) 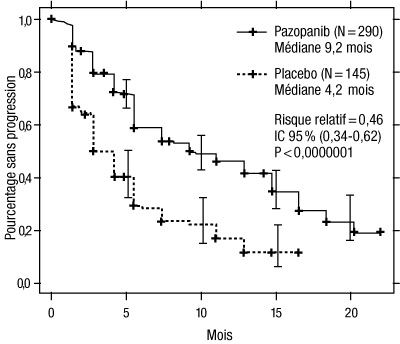
Axe des abscisses : mois ; axe des ordonnées : pourcentage sans progression ; pazopanib (N = 290) : médiane = 9,2 mois ; placebo (N = 145) : médiane = 4,2 mois ; risque relatif = 0,46 ; IC à 95 % (0,34 - 0,62) ; p < 0,0000001.
-
Figure 2 : Courbe de Kaplan-Meier de la survie sans progression selon une évaluation indépendante dans la population de patients non préalablement traités 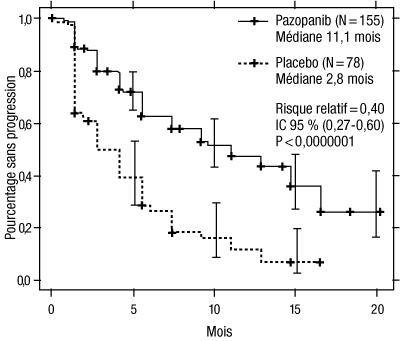
Axe des abscisses : mois ; axe des ordonnées : pourcentage sans progression ; pazopanib (N = 155) : médiane = 11,1 mois ; placebo (N = 78) : médiane = 2,8 mois ; risque relatif = 0,40 ; IC à 95 % (0,27 - 0,60) ; p < 0,0000001.
-
Figure 3 : Courbe de Kaplan-Meier de la survie sans progression selon une évaluation indépendante dans la population de patients prétraités par des cytokines 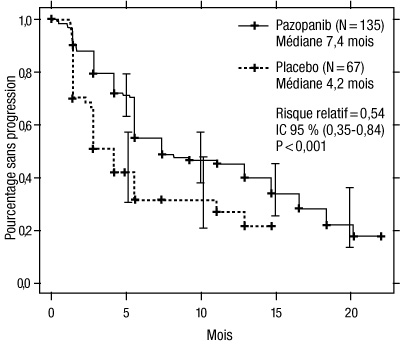
Axe des abscisses : mois ; axe des ordonnées : pourcentage sans progression ; pazopanib (N = 135) : médiane = 7,4 mois ; placebo (N = 67) : médiane = 4,2 mois ; risque relatif = 0,54 ; IC à 95 % (0,35 - 0,84) ; p < 0,001.
- Pour les patients ayant répondu au traitement, le temps de réponse (médiane) était de 11,9 semaines et la durée de réponse (médiane) était de 58,7 semaines selon l'évaluation indépendante.
- Au moment de l'analyse du critère d'évaluation primaire, les données de survie globale n'étaient pas matures.
- Aucune différence statistique n'a été observée entre les groupes de traitement concernant la qualité de vie globale évaluée par les échelles EORTC QLQ-C30 et EuroQoL EQ-5D.
- Dans une étude de phase II de 225 patients présentant un cancer du rein à cellules claires récidivant localement ou métastatique, le taux de réponse objective était de 35 % et la durée de réponse (médiane) était de 68 semaines, selon une évaluation indépendante. La PFS (médiane) était de 11,9 mois.
-
- Population pédiatrique :
- L'Agence européenne du médicament a accordé une dérogation à l'obligation de soumettre les résultats d'études réalisées avec Votrient dans toutes les catégories d'âge de la population pédiatrique dans le cancer du rein (cf Posologie et Mode d'administration pour les information concernant l'usage pédiatrique).
- Une autorisation de mise sur le marché « conditionnelle » a été délivrée pour ce médicament. Cela signifie que des preuves supplémentaires à apporter par ce produit sont attendues. L'Agence européenne du médicament réévaluera toute nouvelle information sur ce médicament chaque année et si nécessaire ce résumé des caractéristiques du produit sera mis à jour.
PHARMACOCINÉTIQUE |
- Absorption :
- Suite à une administration par voie orale d'une dose unique de pazopanib de 800 mg à des patients ayant des tumeurs solides, la concentration plasmatique maximale (Cmax), obtenue après une médiane de 3,5 heures (intervalle de 1,0 à 11,9 heures) était approximativement de 19 µg/ml ± 13 et l'ASCinfini était approximativement de 650 µg x h/ml ± 500. Des administrations journalières entraînent une augmentation de l'ASC(0-24h) d'un facteur 1,23 à 4.
- Il n'y a pas eu d'augmentation importante de l'ASC ou de la Cmax pour des doses de pazopanib supérieures à 800 mg.
- L'imprégnation systémique en pazopanib est augmentée lors d'une administration avec de la nourriture. L'administration de pazopanib au cours d'un repas riche ou pauvre en matières grasses a entraîné une augmentation de l'ASC et de la Cmax d'un facteur 2 environ. Par conséquent, le pazopanib doit être administré au moins 2 heures après ou 1 heure avant un repas (cf Posologie et Mode d'administration).
- L'administration de comprimé écrasé dosé à 400 mg de pazopanib a augmenté l'ASC(0-72h) de 46 %, la Cmax d'un facteur 2 environ et a diminué le Tmax d'approximativement 2 heures par rapport à l'administration d'un comprimé entier. Ces résultats montrent que la biodisponibilité et la vitesse d'absorption orale du pazopanib sont augmentées après l'administration d'un comprimé écrasé par rapport à l'administration d'un comprimé entier (cf Posologie et Mode d'administration).
- Distribution :
- La liaison du pazopanib aux protéines plasmatiques humaines in vivo était de plus de 99 % quelle que soit la concentration comprise dans un intervalle de 10 à 100 µg/ml. Les études in vitro suggèrent que le pazopanib est un substrat pour la P-glycoprotéine (P-gp) et la Breast Cancer Resistance Protein (BCRP).
- Biotransformation :
- Les résultats d'études in vitro ont montré que le métabolisme du pazopanib est médié principalement par le CYP 3A4, avec des contributions mineures du CYP 1A2 et du CYP 2C8. Les quatre principaux métabolites du pazopanib représentent seulement 6 % de l'imprégnation plasmatique. L'un de ces métabolites inhibe la prolifération des cellules endothéliales de la veine ombilicale humaine stimulées par le VEGF avec une puissance similaire à celle du pazopanib. Les autres sont 10 à 20 fois moins actifs. Par conséquent, l'activité du pazopanib est principalement dépendante de l'imprégnation en pazopanib parent.
- Élimination :
- Le pazopanib est éliminé lentement avec une demi-vie moyenne de 30,9 heures après administration de la dose recommandée de 800 mg. L'élimination se fait principalement par les fèces avec une élimination rénale comptant pour moins de 4 % de la dose administrée.
- Populations spéciales :
-
- Insuffisance rénale : Les résultats montrent que moins de 4 % de la dose de pazopanib administrée par voie orale est excrétée dans l'urine sous forme de pazopanib et de métabolites. Les résultats issus d'un modèle de pharmacocinétique de population (données provenant de sujets ayant, à l'inclusion, des valeurs de clairance de la créatinine entre 30,8 et 150 ml/min) ont montré qu'il est peu probable qu'une insuffisance rénale ait un effet cliniquement significatif sur la pharmacocinétique du pazopanib. Aucun ajustement posologique n'est requis chez les patients ayant une clairance de la créatinine supérieure à 30 ml/min. Étant donné qu'aucune donnée n'est disponible avec le pazopanib chez les patients ayant une clairance de la créatinine inférieure à 30 ml/min, il est conseillé d'être prudent avec cette population de patients (cf Posologie et Mode d'administration).
- Insuffisance hépatique : Chez les sujets ayant une insuffisance hépatique modérée, la Cmax médiane et l'ASC(0-6 h) normalisée à une dose de 800 mg de pazopanib une fois par jour étaient augmentées d'un facteur 2 par rapport aux sujets ayant une fonction hépatique normale. Au vu des données de sécurité, de tolérance et de pharmacocinétique, la posologie du pazopanib devra être réduite à 200 mg une fois par jour chez les sujets ayant une insuffisance hépatique modérée (cf Posologie et Mode d'administration). Aucune donnée n'est disponible chez les sujets ayant une insuffisance hépatique légère. Le pazopanib est contre-indiqué chez les patients présentant une insuffisance hépatique sévère (cf Contre-indications).
- Insuffisance rénale : Les résultats montrent que moins de 4 % de la dose de pazopanib administrée par voie orale est excrétée dans l'urine sous forme de pazopanib et de métabolites. Les résultats issus d'un modèle de pharmacocinétique de population (données provenant de sujets ayant, à l'inclusion, des valeurs de clairance de la créatinine entre 30,8 et 150 ml/min) ont montré qu'il est peu probable qu'une insuffisance rénale ait un effet cliniquement significatif sur la pharmacocinétique du pazopanib. Aucun ajustement posologique n'est requis chez les patients ayant une clairance de la créatinine supérieure à 30 ml/min. Étant donné qu'aucune donnée n'est disponible avec le pazopanib chez les patients ayant une clairance de la créatinine inférieure à 30 ml/min, il est conseillé d'être prudent avec cette population de patients (cf Posologie et Mode d'administration).
SÉCURITE PRÉCLINIQUE |
Le profil de sécurité préclinique du pazopanib a été évalué chez des souris, des rats, des lapins et des singes. Dans les études à doses répétées chez les rongeurs, il a été identifié que les effets sur plusieurs types de tissus (os, dent, lit de l'ongle, organes reproducteurs, tissus hématologiques, rein et pancréas) semblent liés à la pharmacologie de l'inhibition du VEGFR et/ou à la perturbation des signaux du VEGF avec des effets plus importants survenant à des taux d'imprégnation plasmatique en dessous des niveaux observés en clinique. Les autres effets observés incluent une perte de poids, des diarrhées et/ou des morbidités soit secondaires à des effets gastro-intestinaux locaux dus à une forte imprégnation du médicament au niveau de la muqueuse locale (singes), soit à des effets pharmacologiques (rongeurs). Sur la base de l'ASC, des lésions hépatiques prolifératives (foyers éosinophiliques et adénomes) ont été mises en évidence chez les souris femelles, lors d'imprégnation 2,5 fois plus importante que l'imprégnation chez l'homme.
- Effets sur la reproduction, la fécondité et le développement du foetus :
- Il a été montré que le pazopanib est embryotoxique et tératogène lorsqu'il est administré chez des rats et des lapins à des imprégnations de plus de 300 fois inférieures à l'imprégnation dans l'espèce humaine (sur la base de l'ASC). Les effets incluent une réduction de la fertilité chez la femelle, une augmentation des risques de perte de l'embryon avant et après implantation, des résorptions précoces, une létalité embryonnaire, une diminution du poids du foetus et des malformations cardiovasculaires. Une diminution de la formation du corps jaune, une augmentation des kystes et une atrophie des ovaires ont également été observés chez les rongeurs. Dans une étude sur la fertilité chez le rat mâle, aucun effet n'a été mis en évidence sur l'accouplement et la fertilité, cependant une diminution du poids des testicules et de l'épididyme ont été observés avec des réductions des taux de production de sperme, de la motilité des spermatozoïdes et des concentrations de sperme dans les testicules et l'épididyme observés à des imprégnations plasmatiques 0,3 fois supérieures à l'imprégnation chez l'Homme (sur la base de l'ASC).
- Génotoxicité :
- Aucune altération génétique n'a été mise en évidence avec le pazopanib lors des essais de génotoxicité (test d'Ames, test d'aberration chromosomique sur lymphocytes périphériques humains et test du micronucleus in vivo chez le rat). Un intermédiaire de fabrication synthétique du pazopanib, qui est également présent dans la substance active finale en faibles quantités, n'était pas mutagénique lors du test d'Ames mais a montré un potentiel génotoxique au cours du test de lymphome de souris et du test du micronucleus chez la souris in vivo.
- Carcinogénicité :
- Le pazopanib n'a pas fait l'objet d'études de cancérogenèse.
MODALITÉS DE CONSERVATION |
- Durée de conservation :
- 2 ans.
Pas de précautions particulières de conservation.
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| Médicament soumis à prescription hospitalière. Prescription réservée aux spécialistes en oncologie ou en hématologie ou aux médecins compétents en cancérologie. Médicament nécessitant une surveillance particulière pendant le traitement. | |
| AMM | EU/1/10/628/001 ; CIP 3400949131341 (RCP rév 01.02.2011) 30 cp 200 mg. |
| EU/1/10/628/003 ; CIP 3400949131570 (RCP rév 01.02.2011) 30 cp 400 mg. | |
| EU/1/10/628/004 ; CIP 3400949131631 (RCP rév 01.02.2011) 60 cp 400 mg. | |
| Collect. | |
| Non remboursable à la date du 08.03.2011 (demande d'admission à l'étude). |
Titulaire de l'AMM : Glaxo Group Ltd, Berkeley Avenue, Greenford, Middlesex, UB6 0NN, Royaume-Uni.
Laboratoire GlaxoSmithKline
100, route de Versailles. 78163 Marly-le-Roi cdx
Tél : 01 39 17 80 00
Info médic :
Tél : 01 39 17 84 44. Fax : 01 39 17 84 45
Pharmacovigilance : Tél : 01 39 17 80 16
