THALIDOMIDE CELGENE®
FORMES et PRÉSENTATIONS |
COMPOSITION |
| p gélule | |
| Thalidomide (DCI) | 50 mg |
Teneur en lactose anhydre : 257,2 mg par gélule.
INDICATIONS |
Thalidomide Celgene doit être prescrit et délivré conformément au Programme de prévention des grossesses (cf Mises en garde et Précautions d'emploi).
POSOLOGIE ET MODE D'ADMINISTRATION |
- Posologie recommandée chez l'adulte :
- La dose recommandée est de 200 mg par jour, par voie orale.
- Un nombre maximal de 12 cycles de 6 semaines doit être pratiqué.
- La prise de Thalidomide Celgene se fera de préférence le soir, en prise unique, afin de réduire l'impact de la somnolence. Les gélules peuvent être prises pendant ou en dehors des repas.
- Une surveillance des patients est particulièrement recommandée dans les domaines suivants : risques thromboemboliques veineux ; neuropathies périphériques ; érythème/réactions cutanées ; bradycardie, syncope et somnolence (cf Mises en garde et Précautions d'emploi, Effets indésirables). Une prise différée, une réduction de dose ou une interruption de traitement peut être nécessaire, selon le grade des critères NCI-CTC.
- Risques thromboemboliques veineux :
- Une thromboprophylaxie doit être administrée au moins pendant les 5 premiers mois du traitement, en particulier chez les patients présentant des facteurs de risque de thrombose supplémentaires. La prescription d'antithrombotiques en prophylaxie, tels que les héparines de bas poids moléculaire ou la warfarine, est recommandée. La décision de mettre en place des mesures prophylactiques antithrombotiques devra être prise au cas par cas en fonction des facteurs de risque individuels supplémentaires (cf Mises en garde et Précautions d'emploi, Interactions, Effets indésirables).
- L'apparition d'une thrombose veineuse impose l'interruption du traitement et la mise en place d'un traitement anticoagulant. Après stabilisation de l'état du patient sous traitement anticoagulant, et après maîtrise des complications liées à l'événement thromboembolique, le traitement par le thalidomide peut être repris à la dose initiale, après évaluation du rapport bénéfice/risque. Le patient doit continuer le traitement anticoagulant durant toute la durée du traitement par le thalidomide.
- Neuropathie périphérique :
- Le tableau 1 décrit les ajustements de posologie consécutifs à une neuropathie périphérique.
- Tableau 1 : Ajustements de la posologie recommandés en cas de neuropathie périphérique en rapport avec le traitement de première ligne du myélome multiple par Thalidomide Celgene.
-
Gravité de la neuropathie Modification de la posologie Grade 1
(paresthésie, faiblesse et/ou perte des réflexes sans perte de fonction)Poursuivre la surveillance du patient à l'aide d'un examen clinique. En cas d'aggravation des symptômes, il convient d'envisager une réduction de la dose. Cependant, une réduction de la dose n'est pas nécessairement suivie d'une amélioration des symptômes Grade 2
(fonction altérée, mais pas d'impact sur les activités quotidiennes)Réduire la dose ou interrompre le traitement et poursuivre la surveillance du patient par examen clinique et neurologique. Interrompre le traitement en cas d'absence d'amélioration ou d'aggravation continue de la neuropathie. En cas de résolution ou de retour au grade 1, le traitement peut être repris si le rapport bénéfice/risque est favorable Grade 3
(activités quotidiennes perturbées)Interrompre le traitement Grade 4
(neuropathie invalidante)Interrompre le traitement
- Personne âgée :
- Aucun ajustement spécifique de la posologie n'est recommandé pour les personnes âgées.
- Patient souffrant d'insuffisance rénale ou hépatique :
- Thalidomide Celgene n'ayant pas été étudié chez les patients souffrant d'insuffisance rénale ou hépatique, il n'existe aucune recommandation de posologie spécifique pour ces populations de patients. Les patients présentant une insuffisance hépatique ou rénale sévère doivent être étroitement suivis pour détecter toute survenue de réactions indésirables.
- Enfant :
- En raison d'un manque de données concernant l'innocuité et l'efficacité, l'utilisation de Thalidomide Celgene n'est pas recommandée chez l'enfant et l'adolescent.
CONTRE-INDICATIONS |
- Hypersensibilité au thalidomide ou à l'un des excipients.
- Femme enceinte (cf Fertilité/Grossesse/Allaitement).
- Femme susceptible de procréer, à moins que toutes les conditions requises par le Programme de prévention des grossesses ne soient remplies (cf Mises en garde et Précautions d'emploi, Fertilité/Grossesse/Allaitement).
- Patient dans l'incapacité de respecter les mesures de contraception exigées (cf Mises en garde et Précautions d'emploi).
MISES EN GARDE et PRÉCAUTIONS D'EMPLOI |
- Effets tératogènes :
- Le thalidomide est un tératogène puissant, provoquant des anomalies congénitales graves, potentiellement létales chez l'enfant à naître après exposition pendant la grossesse. Le thalidomide ne doit en aucun cas être utilisé chez la femme enceinte ou susceptible de l'être, sauf si toutes les conditions du Programme de prévention des grossesses sont remplies. Les conditions du Programme de prévention des grossesses doivent être remplies par tous les patients, et concernent à la fois les hommes et les femmes.
-
-
- Critères permettant de définir qu'une femme est dans l'impossibilité de procréer :
- Toute patiente ou partenaire de patient est considérée comme susceptible de procréer, sauf si elle présente au moins l'un des critères suivants :
- âge >= 50 ans et aménorrhée depuis au moins 1 an ou plus* ;
- ménopause précoce confirmée par un gynécologue spécialisé ;
- salpingo-ovariectomie bilatérale ou hystérectomie ;
- génotype XY, syndrome de Turner, agénésie utérine.
- âge >= 50 ans et aménorrhée depuis au moins 1 an ou plus* ;
-
*
L'aménorrhée faisant suite au traitement d'un cancer ne suffit pas à exclure un risque de grossesse.
-
- Information des patients :
- Chez la femme susceptible de procréer, l'utilisation du thalidomide est contre-indiquée à moins que toutes les conditions suivantes ne soient remplies :
- la patiente comprend les risques tératogènes pour l'enfant à naître en cas d'exposition au cours de la grossesse ;
- elle comprend la nécessité d'une contraception efficace, sans interruption, commencée 4 semaines avant le traitement, poursuivie pendant toute sa durée et jusque 4 semaines après la fin de celui-ci ;
- même en cas d'aménorrhée, toute femme susceptible de procréer doit suivre toutes les mesures de contraception efficaces ;
- elle doit être en mesure de respecter des mesures de contraception efficaces ;
- elle est informée et comprend les conséquences potentielles d'une grossesse et la nécessité de consulter rapidement un médecin s'il existe un risque de grossesse ;
- elle comprend la nécessité de devoir débuter le traitement dès que le thalidomide lui a été délivré après un test de grossesse négatif ;
- elle comprend la nécessité et accepte de faire un test de grossesse toutes les 4 semaines durant le traitement ;
- elle confirme avoir bien compris les risques et les mesures de précaution nécessaires pour l'utilisation du thalidomide.
- la patiente comprend les risques tératogènes pour l'enfant à naître en cas d'exposition au cours de la grossesse ;
- En raison du passage possible du thalidomide dans le sperme, les hommes traités par le thalidomide doivent :
- comprendre les risques tératogènes en cas de rapport sexuel avec une femme susceptible de procréer ;
- comprendre qu'il est nécessaire d'utiliser des préservatifs en cas de rapport sexuel avec une femme susceptible de procréer.
- comprendre les risques tératogènes en cas de rapport sexuel avec une femme susceptible de procréer ;
- Le médecin prescripteur doit s'assurer que :
- les patient(e)s remplissent les conditions requises par le Programme de prévention des grossesses ;
- les patient(e)s confirment avoir compris les conditions sus-mentionnées.
- les patient(e)s remplissent les conditions requises par le Programme de prévention des grossesses ;
-
- Contraception :
- Les femmes susceptibles de procréer doivent utiliser une méthode de contraception efficace pendant 4 semaines avant le début du traitement, pendant toute la durée de celui-ci et jusqu'à 4 semaines après l'arrêt du thalidomide, même en cas d'interruption du traitement, à moins qu'elles ne déclarent une abstinence totale et continue, qui sera confirmée de façon mensuelle. Si la patiente n'utilise aucun moyen contraceptif efficace, elle devra être orientée de préférence vers un médecin compétent pour être conseillée et afin qu'une contraception adaptée soit instaurée.
- Voici des exemples de méthodes de contraception adaptées :
- implant contraceptif ;
- dispositif intra-utérin (DIU) au lévonorgestrel ;
- acétate de médroxyprogestérone retard ;
- stérilisation tubaire ;
- rapports sexuels exclusivement avec un partenaire vasectomisé ; la vasectomie doit avoir été confirmée par deux spermogrammes négatifs ;
- pilules progestatives inhibant l'ovulation (c'est-à-dire désogestrel).
- implant contraceptif ;
- En raison du risque accru d'accidents thromboemboliques veineux chez les patients atteints de myélome multiple, l'utilisation de pilules oestroprogestatives n'est pas recommandée (cf Interactions). Si la patiente est sous pilule oestroprogestative, elle devra utiliser une autre méthode contraceptive, c'est-à-dire l'une des méthodes citées ci-dessus. Le risque thromboembolique persiste pendant 4 à 6 semaines après l'arrêt du contraceptif oral oestroprogestatif.
-
- Test de grossesse :
- Le type de test utilisé doit être d'une sensibilité d'au moins 25 mUI/ml et pratiqué chez les femmes susceptibles de procréer, sous la responsabilité d'un médecin, comme indiqué ci-dessous. Cette exigence inclut les femmes susceptibles de procréer qui pratiquent l'abstinence absolue en permanence.
- Avant de commencer le traitement :
- Un test de grossesse doit être effectué sous contrôle médical lors de la consultation ou dans les 3 jours précédant la consultation lorsque le thalidomide est prescrit si la patiente utilise une contraception efficace depuis au moins 4 semaines. Le test doit confirmer que la patiente n'est pas enceinte au moment où elle débute le traitement par le thalidomide.
- Suivi et arrêt du traitement :
- Un nouveau test de grossesse sous contrôle médical doit être effectué toutes les 4 semaines et jusqu'à 4 semaines après l'arrêt du traitement. Ces tests de grossesse doivent être effectués le jour de la consultation dédiée à la prescription ou dans les 3 jours précédents.
-
- Chez l'homme :
- En raison du passage possible du thalidomide dans le sperme, tous les hommes doivent utiliser des préservatifs pendant toute la durée du traitement si leur partenaire est enceinte ou susceptible de procréer et n'utilise pas de méthode contraceptive, et pendant 1 semaine à l'issue du traitement et/ou en cas d'interruption des prises.
-
- Restrictions en matière de prescription et de délivrance :
- Chez les femmes en âge de procréer, les prescriptions de Thalidomide Celgene doivent se limiter à 4 semaines de traitement et la poursuite du traitement nécessite une nouvelle prescription. Idéalement, le test de grossesse, la prescription et la délivrance auront lieu le même jour. La délivrance du thalidomide devrait avoir lieu au plus tard 7 jours après la prescription.
- Pour tous les autres patients, les prescriptions de Thalidomide Celgene doivent se limiter à 12 semaines et la poursuite du traitement nécessite une nouvelle prescription.
-
- Précautions supplémentaires :
- Les patients doivent être informés de ne jamais donner leur médicament à quelqu'un d'autre et de rapporter les gélules non utilisées à leur pharmacien en fin de traitement.
- Les patients ne doivent pas faire de don de sang ou de sperme pendant la prise de thalidomide et pendant 1 semaine après la fin du traitement.
- Documents d'information :
- Afin d'aider les professionnels de santé à éviter toute exposition foetale au thalidomide et de fournir des informations supplémentaires de sécurité importantes, le titulaire de l'Autorisation de mise sur le marché leur fournira des documents d'information. Le Programme de prévention des grossesses Thalidomide Celgene renforce les mises en garde relatives à la tératogénicité du thalidomide, proposant des conseils pour la mise en place d'une contraception préalable au traitement et fournissant des explications sur les tests de grossesse nécessaires. Des informations complètes sur le risque tératogène du thalidomide et sur les mesures contraceptives définies par le Programme de prévention des grossesses doivent être données par le médecin aux femmes susceptibles de procréer et, le cas échéant, aux hommes.
- Affections cardiovasculaires :
-
- Infarctus du myocarde :
- Des cas d'infarctus du myocarde (IDM) ont été rapportés chez des patients recevant du thalidomide, notamment chez ceux qui présentent des facteurs de risque connus. Une surveillance étroite s'impose chez les patients présentant des facteurs de risque connus d'IDM, parmi lesquels un antécédent de thrombose. Des mesures doivent être prises pour essayer de réduire au minimum tous les facteurs de risque modifiables (par exemple, le tabagisme, l'hypertension et l'hyperlipidémie).
-
- Événements thromboemboliques veineux et artériels :
- Le risque de thromboembolie veineuse (telle que thrombose veineuse profonde, embolie pulmonaire) et de thromboembolie artérielle (telle qu'infarctus du myocarde, accident vasculaire cérébral) est majoré chez les patients traités par le thalidomide (cf Effets indésirables). Le risque semble plus important au cours des 5 premiers mois du traitement. Des recommandations relatives à la thromboprophylaxie et au traitement anticoagulant figurent à la rubrique Posologie et Mode d'administration.
- Des antécédents d'événements thromboemboliques ou d'administration concomitante d'agents érythropoïétiques ou d'autres agents, tels qu'un traitement hormonosubstitutif, peuvent aussi accroître le risque thromboembolique chez ces patients. De ce fait, il convient d'utiliser ces agents avec prudence chez des patients atteints d'un myélome multiple qui reçoivent le thalidomide en même temps que la prednisone et le melphalan. En particulier, une concentration d'hémoglobine supérieure à 12 g/dl doit conduire à l'arrêt des agents érythropoïétiques. Des mesures doivent être prises pour réduire au minimum tous les facteurs de risque modifiables (par exemple, le tabagisme, l'hypertension et l'hyperlipidémie).
- Il est conseillé aux patients et aux médecins d'être attentifs à la survenue éventuelle des signes et symptômes d'une thromboembolie. Il sera demandé aux patients de consulter leur médecin s'ils développent des symptômes tels qu'essoufflement, douleurs thoraciques, oedème dans les bras ou les jambes.
- Neuropathie périphérique :
- La neuropathie périphérique est un effet indésirable très fréquent, potentiellement grave, associé au traitement par le thalidomide, pouvant entraîner des lésions irréversibles (cf Effets indésirables). Dans une étude de phase 3, le temps médian avant le premier événement de neuropathie était de 42,3 semaines.
- Si le patient présente une neuropathie périphérique, il convient de suivre les instructions relatives aux modifications de dose et de schéma thérapeutique fournies à la rubrique Posologie et Mode d'administration.
- Il est recommandé de suivre étroitement les patients afin de détecter tout symptôme de neuropathie. Les symptômes incluent la paresthésie, la dysesthésie, la gêne, la coordination anormale ou la faiblesse.
- Des examens neurologiques et cliniques avant le début du traitement par le thalidomide et une surveillance régulière pendant le traitement sont recommandés. Les médicaments associés à un risque de neuropathie doivent être utilisés avec précaution chez les patients recevant du thalidomide (cf Interactions).
- Le thalidomide risque également d'aggraver une neuropathie existante. Il ne doit donc pas être administré à des patients présentant des signes ou des symptômes cliniques de neuropathie périphérique à moins que les bénéfices cliniques ne soient supérieurs aux risques.
- Syncope et bradycardie :
- Les patients doivent faire l'objet d'une surveillance en raison du risque de syncope et de bradycardie, effets pouvant nécessiter une réduction de la dose ou un arrêt du traitement.
- Réactions cutanées :
- En cas de réaction cutanée grave (par exemple syndrome de Stevens-Johnson), interrompre définitivement le traitement.
- Somnolence :
- Le thalidomide est associé à un risque important de somnolence. Les patients doivent être informés de ce risque de somnolence et demander un avis médical avant de prendre d'autres médicaments connus pour provoquer une somnolence. Les patients doivent faire l'objet d'un suivi et une réduction de dose peut s'avérer nécessaire.
- Les patients doivent être informés quant à la possibilité d'affaiblissement des capacités mentales et/ou physiques nécessaires à l'exécution des tâches dangereuses (cf Conduite et Utilisation de machines).
- Syndrome de lyse tumorale :
- Les patients présentant des risques de syndrome de lyse tumorale sont ceux qui ont une charge tumorale élevée avant le traitement. Ces patients doivent faire l'objet d'une surveillance étroite et les précautions appropriées doivent être prises.
- Patients atteints d'insuffisance rénale ou hépatique :
- Les études menées chez des volontaires sains et des patients atteints d'un myélome multiple semblent indiquer que la fonction rénale ou hépatique n'influe pas de façon significative sur le thalidomide (cf Pharmacocinétique). Cependant, cela n'a pas été étudié formellement chez les patients atteints d'insuffisance rénale ou hépatique. Par conséquent, les patients présentant une insuffisance rénale ou hépatique sévère doivent être suivis étroitement afin de détecter toute survenue d'effets indésirables.
- Intolérance au lactose :
- Les gélules contiennent du lactose (cf Composition). Ce médicament est contre-indiqué chez les patients présentant une intolérance au galactose, un déficit en lactase de Lapp ou un syndrome de malabsorption du glucose et du galactose (maladies héréditaires rares).
INTERACTIONS |
- Augmentation des effets sédatifs d'autres médicaments :
- Le thalidomide possède des propriétés sédatives susceptibles d'augmenter la sédation due aux anxiolytiques, aux hypnotiques, aux antipsychotiques, aux antihistaminiques H1, aux dérivés d'opiacés, aux barbituriques et à l'alcool. Il convient d'utiliser le thalidomide avec précaution lors de l'association à des médicaments susceptibles d'entraîner une somnolence.
- Effet bradycardique :
- Les médicaments, tels que les substances actives connues pour induire des torsades de pointe, les bêtabloquants ou les anticholinestérasiques ayant le même effet pharmacodynamique que le thalidomide (connu pour être à l'origine de bradycardie) doivent être utilisés avec précaution.
- Médicaments connus pour leur risque de neuropathie périphérique :
- Les médicaments possédant un risque de neuropathie périphérique (par exemple la vincristine et le bortézomib) doivent être utilisés avec précaution chez les patients recevant du thalidomide.
- Contraceptifs hormonaux :
- Le thalidomide ne présente pas d'interaction avec les contraceptifs hormonaux, comme l'a montré l'étude du profil pharmacocinétique de l'association de 0,1 mg d'acétate de noréthindrone et de 0,75 mg d'éthinyloestradiol, administrés en dose unique chez 10 sujets sains de sexe féminin. Les résultats ont en effet été similaires (temps à la concentration maximale) avec et sans la coadministration de 200 mg/jour de thalidomide. Cependant, l'administration concomitante de contraceptifs hormonaux n'est pas recommandée en raison du risque accru de maladie thromboembolique veineuse.
- Warfarine :
- L'administration de plusieurs doses de 200 mg de thalidomide par jour pendant 4 jours n'a eu aucun effet sur le temps de Quick exprimé en INR (International Normalized Ratio) chez des volontaires sains. Cependant, en raison du risque accru de thrombose chez les patients atteints d'un cancer et d'accélération du métabolisme de la warfarine avec les corticostéroïdes, une surveillance étroite du temps de Quick, exprimé en INR, est recommandée pendant l'administration concomitante de thalidomide-prednisone et pendant les premières semaines suivant l'arrêt de ces traitements.
- Digoxine :
- Le thalidomide ne présente pas d'interaction avec la digoxine. L'administration de plusieurs doses de 200 mg de thalidomide à 18 volontaires sains de sexe masculin n'a eu aucun effet apparent sur la pharmacocinétique de la digoxine administrée en dose unique. En outre, l'administration d'une dose unique de digoxine de 0,5 mg n'a eu aucun effet apparent sur la pharmacocinétique du thalidomide. On ne sait pas si l'effet sera différent chez les patients atteints de myélome multiple.
FERTILITÉ/GROSSESSE/ALLAITEMENT |
Le thalidomide est un tératogène puissant, induisant une fréquence élevée (environ 30 %) d'anomalies congénitales graves, potentiellement létales, telles que : ectromélie (amélie, phocomélie, hémimélie) des membres supérieurs et/ou inférieurs, microtie avec anomalie de l'orifice externe du conduit auditif (totale ou partielle), lésions de l'oreille moyenne et interne (moins fréquentes), lésions oculaires (anophtalmie, microphtalmie), cardiopathie congénitale, anomalies rénales. D'autres anomalies moins fréquentes ont été également décrites.
Femmes susceptibles de procréer :
Les femmes susceptibles de procréer doivent recourir à une méthode de contraception efficace 4 semaines avant le traitement, pendant toute la durée du traitement et 4 semaines après la fin du traitement par le thalidomide (cf Mises en garde et Précautions d'emploi).
En cas de survenue d'une grossesse chez une femme traitée par le thalidomide, le traitement doit être immédiatement arrêté et la patiente doit être adressée à un médecin spécialiste ou expérimenté en tératologie pour évaluation et conseil.
Hommes ayant des rapports avec des partenaires susceptibles de procréer :
En raison du passage du thalidomide dans le sperme, les hommes doivent utiliser des préservatifs pendant toute la durée du traitement et pendant 1 semaine à l'interruption et/ou à l'issue du traitement quand ils ont des rapports sexuels avec une femme enceinte ou une femme susceptible de l'être et qui n'utilise pas de méthode de contraception.
Si une grossesse survient chez la partenaire d'un patient sous thalidomide, la partenaire doit être orientée vers un médecin qui est spécialisé ou a de l'expérience en tératologie pour évaluation et conseil.
Allaitement :
Aucune donnée ne permet de savoir si le thalidomide est excrété dans le lait maternel. Des études sur les animaux ont montré l'excrétion du thalidomide dans le lait. Par conséquent, l'allaitement doit être interrompu pendant le traitement par le thalidomide.
CONDUITE et UTILISATION DE MACHINES |
Cependant, le thalidomide peut être à l'origine de somnolence et de troubles de la vision (cf Effets indésirables). Il faut donc déconseiller aux patients la conduite de véhicules, l'utilisation de machines ou la réalisation de tâches dangereuses durant le traitement par le thalidomide.
EFFETS INDÉSIRABLES |
Les effets indésirables les plus graves observés chez les patients ayant reçu du thalidomide en association avec du melphalan et de la prednisone ou de la dexaméthasone sont : thrombose veineuse profonde et embolie pulmonaire, neuropathie périphérique, réactions cutanées graves comprenant syndrome de Stevens-Johnson et nécrolyse épidermique toxique, syncope, bradycardie et vertiges (cf Posologie et Mode d'administration, Mises en garde et Précautions d'emploi, Interactions).
Le tableau 2 indique uniquement les effets indésirables pour lesquels une relation avec le médicament peut être raisonnablement établie. Les fréquences indiquées sont basées sur des observations réalisées au cours d'une étude clinique comparative pivot portant sur l'effet du thalidomide en association avec le melphalan et la prednisone chez des patients souffrant de myélome multiple traités pour la première fois. En plus des effets indésirables observés dans l'étude pivot, des effets indésirables associés à l'utilisation concomitante de thalidomide et de dexaméthasone et basés sur la pharmacovigilance du médicament sont présentés après le tableau 2.
Les fréquences sont définies comme suit : très fréquent (>= 1/10) ; fréquent (>= 1/100 à < 1/10) ; peu fréquent (>= 1/1000 à < 1/100) ; rare (>= 1/10 000 à < 1/1000) ; très rare (< 1/10 000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Au sein de chaque fréquence de groupe, les effets indésirables sont présentés suivant un ordre décroissant de gravité.
Tableau 2 : Fréquence des effets indésirables du thalidomide coadministré avec du melphalan et de la prednisone.
| Classe de systèmes d'organes | Très fréquent | Fréquent |
| Affections cardiaques | Insuffisance cardiaque, bradycardie | |
| Affections hématologiques et du système lymphatique | Neutropénie, leucopénie, anémie, lymphopénie, thrombocytopénie | |
| Affections du système nerveux | Neuropathie périphérique*, tremblements, vertiges, paresthésie, dysesthésie, somnolence | Coordination anormale |
| Affections respiratoires, thoraciques et médiastinales | Embolie pulmonaire*, atteinte pulmonaire interstitielle, bronchopneumopathie, dyspnée | |
| Affections gastro-intestinales | Constipation | Vomissements, bouche sèche |
| Affections de la peau et du tissu sous-cutané | Toxidermie, érythème, sécheresse cutanée | |
| Infections et infestations | Pneumonie | |
| Affections vasculaires | Thrombose veineuse profonde* | |
| Troubles généraux et anomalies au site d'administration | OEdème périphérique | Pyrexie, asthénie, malaise |
| Affections psychiatriques | État confusionnel, dépression |
* Voir détails ci-dessous.
Outre les effets indésirables ci-dessus, l'association de thalidomide et de dexaméthasone, telle qu'observée dans d'autres études cliniques, peut être à l'origine d'effets indésirables très fréquents : fatigue ; fréquents : accident ischémique transitoire, syncope, vertiges, hypotension, troubles de l'humeur, anxiété, troubles de la vision, nausées et dyspepsie ; peu fréquents : accident cérébrovasculaire, perforation diverticulaire, péritonite, hypotension orthostatique et bronchite.
Les autres effets indésirables observés lors du suivi de pharmacovigilance du thalidomide et qui n'ont pas été observés dans l'étude pivot comprennent : nécrolyse épidermique toxique, obstruction intestinale, hypothyroïdie, dysfonctionnement érectile, syndrome de lyse tumorale, perforations gastro-intestinales, hypersensibilité, diminution de l'audition ou surdité, insuffisance rénale, infarctus du myocarde et aggravation des symptômes parkinsoniens.
- Affections hématologiques et du système lymphatique :
- Les effets indésirables hématologiques sont présentés comparativement à ceux observés avec le comparateur, en raison des effets indésirables significatifs de celui-ci dans ces affections (tableau 3).
- Tableau 3 : Comparaison des affections hématologiques pour les associations melphalan-prednisone (MP) et melphalan-prednisone-thalidomide (MPT) dans l'étude IFM 99-06 (cf Pharmacodynamie).
-
MP (n = 193) MPT (n = 124) n (% de patients) Grades 3 et 4* Neutropénie 57 (29,5) 53 (42,7) Leucopénie 32 (16,6) 32 (25,8) Anémie 28 (14,5) 17 (13,7) Lymphopénie 14 (7,3) 15 (12,1) Thrombocytopénie 19 (9,8) 14 (11,3) -
*
Critères de l'OMS.
- Une neutropénie fébrile et une pancytopénie, non observées dans l'étude pivot, ont été rapportées comme effets indésirables supplémentaires lors du suivi postcommercialisation du thalidomide.
- Tératogénicité :
- Le risque de morts in utero ou d'anomalies congénitales graves, principalement la phocomélie, est extrêmement élevé. Le thalidomide ne doit en aucun cas être administré pendant la grossesse (cf Mises en garde et Précautions d'emploi, Fertilité/Grossesse/Allaitement).
- Événements thromboemboliques veineux et artériels :
- Un risque accru de thromboembolie veineuse (telle que thrombose veineuse profonde, embolie pulmonaire) et de thromboembolie artérielle (telle qu'infarctus du myocarde, accident vasculaire cérébral) a été décrit chez les patients recevant du thalidomide (cf Mises en garde et Précautions d'emploi).
- Neuropathie périphérique :
- La neuropathie périphérique est un effet indésirable très fréquent, potentiellement grave, associé au traitement par le thalidomide, pouvant entraîner des lésions irréversibles (cf Mises en garde et Précautions d'emploi).
- La neuropathie périphérique se produit généralement à la suite d'une administration prolongée.
- Toutefois, certains cas ont été observés après une utilisation de courte durée. L'incidence des événements neuropathiques menant à l'arrêt, à la réduction ou à l'interruption de la dose augmente avec une dose cumulée et avec la durée du traitement. Les symptômes peuvent apparaître un certain temps après l'arrêt du traitement par le thalidomide. Ils peuvent disparaître lentement ou pas du tout.
SURDOSAGE |
PHARMACODYNAMIE |
Classe pharmacothérapeutique : immunosuppresseur (code ATC : L04AX02).
Le thalidomide est une molécule chirale. C'est le racémate (+)-(R)- et (-)-(S)-thalidomide qui est utilisé. Le spectre d'activité du thalidomide n'est pas entièrement caractérisé.
Le thalidomide présente des propriétés anti-inflammatoires, immunomodulatrices et potentiellement antitumorales. Les essais in vitro et les études cliniques suggèrent que les effets immunomodulateurs, anti-inflammatoires et antitumoraux du thalidomide sont liés à l'inhibition de la production de TNF-alpha (Tumor Necrosis Factor-alpha), à une intervention sur les molécules de surface impliquées dans la migration des leucocytes et à une activité antiangiogénique.
Le thalidomide possède également des propriétés hypnotiques et sédatives d'origine centrale, différentes de celles des barbituriques. Il n'a aucun effet antibactérien.
- Efficacité clinique :
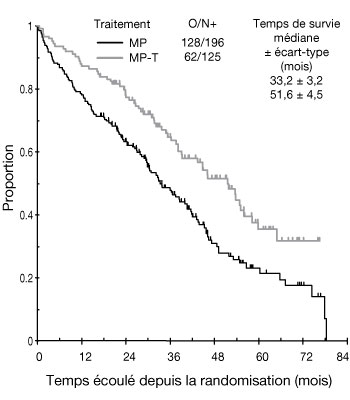
- Les résultats de l'étude multicentrique, en groupes parallèles, ouverte et randomisée de phase 3 IFM 99-06 ont fait apparaître un gain de survie quand le thalidomide est utilisé en association avec le melphalan et la prednisone pendant 12 cycles de 6 semaines pour le traitement du myélome multiple nouvellement diagnostiqué. Dans cette étude, les patients étaient âgés de 65 à 75 ans, avec 41 % (183/447) des patients âgés de 70 ans ou plus. La dose médiane de thalidomide était de 217 mg et 40 % des patients ont reçu 9 cycles. Le melphalan et la prednisone ont été administrés à une dose de, respectivement, 0,25 mg/kg/jour et 2 mg/kg/jour les jours 1 à 4 de chaque cycle de 6 semaines.
- Suite à l'analyse per protocole, une actualisation a été réalisée pour l'étude IFM 99-06, fournissant des données de suivi supplémentaires de 15 mois. La survie globale médiane était de 51,6 mois ± 4,5 et de 33,2 mois ± 3,2 dans les groupes MPT et MP, respectivement (IC à 97,5 % : 0,42 à 0,84). Cette différence de 18 mois était statistiquement significative, avec un hazard ratio de réduction du risque de décès dans le groupe MPT de 0,59, intervalle de confiance à 97,5 % de 0,42-0,84 et valeur p de < 0,001 (voir figure 1).
| Figure 1 : Taux de survie globale selon le traitement : |
 |
PHARMACOCINÉTIQUE |
- Absorption :
- L'absorption du thalidomide est lente après administration par voie orale. Les concentrations plasmatiques maximales sont atteintes entre 1 et 5 heures après l'administration. L'ingestion concomitante d'aliments retarde l'absorption mais n'a pas d'incidence sur le niveau d'absorption.
- Distribution :
- Le taux de liaison avec les protéines plasmatiques des énantiomères (+)-(R) et (-)-(S) est respectivement de 55 % et de 65 %. Le thalidomide est présent dans le sperme à des niveaux similaires aux concentrations plasmatiques. Par conséquent, en raison des risques tératogènes importants connus du produit, pendant le traitement par le thalidomide et pendant 1 semaine après l'arrêt du traitement, les patients hommes doivent utiliser des préservatifs si leur partenaire est enceinte ou est susceptible de le devenir et si elle n'utilise pas de méthode de contraception efficace (cf Mises en garde et Précautions d'emploi).
- Métabolisme :
- Le thalidomide est métabolisé presque exclusivement par hydrolyse non enzymatique. Dans le plasma, le thalidomide sous forme inchangée représente 80 % des composants en circulation. Le thalidomide sous forme inchangée est un composant mineur (moins de 3 % de la dose) dans les urines. En plus du thalidomide, les produits hydrolytiques N-(o-carboxybenzoyle) glutarimide et phthaloyl-isoglutamine, issus de processus non enzymatiques, sont également retrouvés dans le plasma et en majorité dans les urines. Le métabolisme oxydatif ne contribue pas de façon significative au métabolisme global du thalidomide.
- Le thalidomide subit une métabolisation hépatique limitée, catalysée par le cytochrome P450. Des données in vitro indiquent que la prednisone peut donner lieu à une induction enzymatique susceptible de réduire l'exposition systémique des médicaments pris en concomitance. La pertinence in vivo de ces observations n'est pas connue.
- Élimination :
- La demi-vie d'élimination moyenne du thalidomide dans le plasma après des doses uniques comprises entre 50 et 400 mg administrées par voie orale était de 5,5 à 7,3 heures. L'exposition systémique totale (ASC) est proportionnelle à la dose pour des doses uniques. Aucune dépendance temporelle de la pharmacocinétique n'a été observée.
- Après administration d'une dose orale unique de 400 mg de thalidomide radiomarqué, la récupération moyenne totale, au jour 8, a été de 93,6 % de la dose administrée. La majorité de la dose radioactive a été excrétée dans les 48 heures suivant l'administration. La voie rénale a été la voie principale d'élimination (plus de 90 %), tandis que l'excrétion fécale a été mineure.
- Il existe une relation linéaire entre le poids et la clairance estimée du thalidomide. Chez des patients atteints d'un myélome multiple pesant de 47 à 133 kg, la clairance du thalidomide a été d'environ 6 à 12 l/h, ce qui représente une augmentation de la clairance de 0,621 l/h pour chaque augmentation du poids de 10 kg. Cependant, l'âge, le sexe, la fonction rénale et les paramètres biologiques cliniques n'ont pas d'effet significatif sur la distribution du thalidomide.
- Insuffisance rénale et hépatique :
- Le métabolisme du thalidomide par le système du cytochrome P450 est minime et le thalidomide sous forme inchangée n'est pas éliminé par voie rénale. Les mesures de la fonction rénale (ClCr) et de la fonction hépatique (paramètres sanguins) indiquent un effet minime de ces fonctions sur la pharmacocinétique du thalidomide. De ce fait, le métabolisme du thalidomide n'est pas susceptible d'être modifié en cas d'insuffisance hépatique ou rénale. Les données chez des patients atteints d'insuffisance rénale terminale semblent indiquer l'absence d'effet de la fonction rénale sur la pharmacocinétique du thalidomide. Cependant, les métabolites pharmacologiquement actifs étant éliminés dans les urines, il est recommandé de surveiller étroitement la survenue d'effets indésirables chez les patients présentant une insuffisance rénale sévère.
SÉCURITE PRÉCLINIQUE |
Chez le chien mâle, après une année d'administration, des bouchons biliaires dans les canalicules ont été observés à des expositions supérieures à 1,9 fois l'exposition humaine.
Une diminution du nombre de plaquettes a été observée dans les études menées sur la souris et le rat. Cette diminution semble être liée au thalidomide et a été observée à des expositions supérieures à 2,4 fois l'exposition humaine. Cette diminution n'a pas induit de signes cliniques.
Dans une étude d'un an menée sur des chiens, on a observé une hypertrophie et/ou une coloration bleuâtre des glandes mammaires et un cycle oestral prolongé chez les femelles soumises à des expositions de respectivement 1,8 fois l'exposition humaine ou supérieures à 3,6 fois l'exposition humaine. La pertinence pour les êtres humains est inconnue.
L'effet du thalidomide sur la fonction thyroïdienne a été évalué chez des rats et des chiens. Aucun effet n'a été observé chez les chiens. Toutefois, une baisse apparente liée à la dose des taux de T4 libre et totale a été observée chez les rats, plus particulièrement chez les femelles.
Aucun effet mutagène ni génotoxique n'a été mis en évidence lors des essais de génotoxicité menés sur le thalidomide. Aucune preuve de cancérogénicité n'a été observée après une exposition d'environ 15, 13 et 39 fois la dose de départ recommandée chez les souris, les rats mâles et les rats femelles, respectivement.
L'effet tératogène du thalidomide chez l'animal dépend des espèces. Le thalidomide est tératogène chez l'homme.
Une étude sur les lapins n'a démontré aucun effet sur les indices de fertilité chez les mâles ou les femelles, bien qu'une dégénérescence des testicules ait été observée chez les mâles.
Une étude péri- et postnatale menée sur les lapins et évaluant le thalidomide administré à des doses allant jusqu'à 500 mg/kg/jour a provoqué des avortements, une augmentation du nombre de mort-nés et une baisse de viabilité de la descendance pendant l'allaitement. Chez les lapins dont la mère a reçu du thalidomide, on a observé une hausse de la fréquence des avortements, un ralentissement de la prise de poids, des troubles d'apprentissage et de mémoire, une baisse de fertilité et une baisse d'indice de gestation.
MODALITÉS DE CONSERVATION |
- Durée de conservation :
- 3 ans.
Pas de précautions particulières de conservation.
MODALITÉS MANIPULATION/ÉLIMINATION |
Retourner toutes les gélules non utilisées au pharmacien à la fin du traitement.
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| « Médicament soumis à prescription hospitalière. Prescription réservée aux spécialistes en oncologie, hématologie, médecine interne, dermatologie, gastroentérologie, néphrologie ou stomatologie, ou aux médecins compétents en cancérologie. | |
|
|
| AMM | EU/1/08/443/001 ; CIP 3400957267766 (RCP rév 18.04.2011). |
| Collect. | |
| Inscrit sur la liste de rétrocession avec prise en charge à 100 %. |
CELGENE
16-18, rue du Quatre-Septembre. 75002 Paris
Tél : 01 53 42 43 00. Fax : 01 53 42 43 20
