IRESSA®
géfitinib
FORMES et PRÉSENTATIONS |
COMPOSITION |
| p cp | |
| Géfitinib (DCI) | 250 mg |
Teneur en lactose monohydraté : 163,5 mg/cp.
INDICATIONS |
POSOLOGIE ET MODE D'ADMINISTRATION |
Posologie :
La posologie recommandée d'Iressa est d'un comprimé de 250 mg une fois par jour. Si une dose d'Iressa a été oubliée, elle doit être prise aussitôt que le patient s'en souvient. S'il reste moins de 12 heures avant la prise de la prochaine dose, le patient ne doit pas prendre la dose oubliée. Les patients ne doivent pas prendre une double dose (deux doses en même temps) pour compenser une dose oubliée.
Coût du traitement journalier : 75,75 euro(s).- Population pédiatrique :
- La sécurité et l'efficacité d'Iressa n'ont pas été établies chez les enfants et chez les adolescents âgés de moins de 18 ans. Il n'y a pas d'utilisation justifiée d'Iressa dans l'indication du CBNPC pour une population pédiatrique.
- Insuffisance hépatique :
- Les patients avec une insuffisance hépatique modérée à sévère (Child Pugh B ou C) suite à une cirrhose ont une augmentation des concentrations plasmatiques du géfitinib. Une surveillance étroite des effets indésirables chez ces patients doit être effectuée. Les concentrations plasmatiques ne sont pas augmentées chez les patients qui ont une élévation de l'aspartate aminotransférase (ASAT), des phosphatases alcalines ou de la bilirubine suite à des métastases hépatiques (cf Pharmacocinétique).
- Insuffisance rénale :
- Aucun ajustement de dose n'est nécessaire chez les patients ayant une insuffisance rénale avec une clairance de la créatinine > 20 ml/min. Des données limitées sont disponibles chez les patients avec une clairance de la créatinine <= 20 ml/min et une attention est requise chez ces patients (cf Pharmacocinétique).
- Sujet âgé :
- Aucun ajustement de dose n'est nécessaire en fonction de l'âge des patients (cf Pharmacocinétique).
- CYP2D6 métaboliseurs lents :
- Aucun ajustement spécifique de dose n'est recommandé chez les patients avec un génotype CYP 2D6 métaboliseurs lents connus, mais une surveillance étroite des effets indésirables chez ces patients doit être effectuée (cf Pharmacocinétique).
- Ajustement de la dose en fonction de la toxicité :
- Les patients présentant une diarrhée mal tolérée ou des réactions indésirables cutanées, peuvent être pris en charge efficacement par une courte interruption du traitement (jusqu'à 14 jours) suivie de sa reprise à la dose de 250 mg (cf Effets indésirables). Pour les patients ne supportant pas le traitement après une interruption de la thérapie, Iressa doit être arrêté et un traitement alternatif doit être envisagé.
Mode d'administration :
Le comprimé peut être pris avec ou sans aliment, chaque jour, approximativement vers la même heure. Le comprimé peut être entièrement avalé avec un peu d'eau ou si l'administration des comprimés entiers n'est pas possible, les comprimés peuvent être administrés après dispersion dans l'eau (non pétillante). Aucune autre boisson ne doit être utilisée. Sans l'écraser, le comprimé doit être mis dans un demi-verre d'eau. Le verre doit être remué de temps en temps jusqu'à dissolution du comprimé (cela peut prendre jusqu'à 20 minutes). La dispersion doit être bue immédiatement après dissolution totale (c'est-à-dire avant 60 minutes). Rincer correctement le verre avec un demi-verre d'eau qui doit aussi être bu. La dispersion peut également être administrée par sonde nasogastrique ou par sonde de gastrostomie.
CONTRE-INDICATIONS |
- Hypersensibilité à la substance active ou à l'un des excipients.
- Allaitement (cf Fertilité/Grossesse/Allaitement).
MISES EN GARDE et PRÉCAUTIONS D'EMPLOI |
- Évaluation du statut de la mutation de l'EGFR :
- Lors de l'évaluation du statut de la mutation de l'EGFR chez un patient, il est important de choisir une méthode robuste et bien validée pour éviter les déterminations de faux négatifs ou de faux positifs.
- Affections pulmonaires interstitielles (API) :
- Des API, qui peuvent être aiguës dès le début, ont été observées chez 1,3 % des patients traités par Iressa ; certains cas ont eu une évolution fatale (cf Effets indésirables). Si les patients présentent une aggravation des symptômes respiratoires, tels que dyspnée, toux et fièvre, le traitement par Iressa doit être interrompu et le patient doit être examiné rapidement. En cas de confirmation d'une API, le traitement par Iressa doit être arrêté et le patient pris en charge de manière appropriée.
- Dans une étude pharmaco-épidémiologique japonaise cas-témoins chez 3159 patients ayant un CBNPC, sous Iressa ou chimiothérapie, et suivis jusqu'à 12 semaines, les facteurs de risque de survenue d'une API aiguë suivants (indépendamment du fait que le patient ait reçu Iressa ou une chimiothérapie) ont été identifiés : tabagisme, indice de performance faible (PS >= 2), des preuves scanographiques de la diminution de la surface pulmonaire saine (<= 50 %), diagnostic récent de CBNPC (< 6 mois), pneumopathie interstitielle pré-existante, âge (>= 55 ans) et pathologie cardiaque associée. Une augmentation du risque d'API sous géfitinib par rapport à la chimiothérapie a été principalement observée durant les 4 premières semaines de traitement (OR ajusté 3,8 ; 95 % IC : 1,9 à 7,7) ; au-delà le risque relatif était plus faible (OR ajusté 2,5 ; 95 % IC : 1,1 à 5,8). Sous géfitinib ou chimiothérapie, le risque de mortalité chez les patients ayant développé une API est plus élevé chez les patients présentant les facteurs de risque suivants : tabagisme, preuves scanographiques de la diminution de la surface pulmonaire saine (<= 50 %), API pré-existante, âge (>= 65 ans), et des zones étendues adhérentes à la plèvre (>= 50 %).
- Hépatotoxicité et insuffisance hépatique :
- Des anomalies du bilan hépatique (incluant augmentation de l'alanine aminotransférase, de l'aspartate aminotransférase, de la bilirubine) ont été observées, se présentant peu fréquemment sous forme d'hépatite (cf Effets indésirables). Il y a eu des cas isolés d'insuffisance hépatique qui ont, dans certains cas, conduit à une issue fatale. En conséquence, une surveillance régulière du bilan hépatique est recommandée. Iressa devra être utilisé avec prudence en présence d'une modification de la fonction hépatique légère à modérée. L'arrêt du traitement devra être envisagé en cas de modifications sévères.
- Une insuffisance hépatique due à une cirrhose entraîne une augmentation des concentrations plasmatiques de géfitinib (cf Pharmacocinétique).
- Interactions avec d'autres médicaments :
- Les inducteurs du CYP 3A4 peuvent augmenter le métabolisme du géfitinib et réduire les concentrations plasmatiques du géfitinib. Par conséquent, la prise concomitante d'inducteurs du CYP 3A4 (par exemple, phénytoïne, carbamazépine, rifampicine, barbituriques ou préparations à base de plantes contenant du millepertuis/Hypericum perforatum) peut diminuer l'efficacité du traitement et doit être évitée (cf Interactions).
- Chez les patients avec un génotype CYP 2D6 métaboliseur lent, un traitement avec un inhibiteur puissant du CYP 3A4 peut entraîner une augmentation de la concentration plasmatique du géfitinib. A l'initiation d'un traitement par un inhibiteur du CYP 3A4, la survenue d'effets indésirables chez ces patients doit être étroitement surveillée (cf Interactions).
- Une élévation de l'INR (International Normalised Ratio) et/ou des épisodes hémorragiques ont été rapportés chez certains patients traités par la warfarine en association avec le géfitinib (cf Interactions). Chez les patients traités simultanément par la warfarine et le géfitinib, le temps de prothrombine (TP) ou l'INR doivent être régulièrement contrôlés.
- Les médicaments qui entraînent une augmentation significative et durable du pH gastrique tels que les inhibiteurs de la pompe à protons et les antagonistes des récepteurs H2 peuvent réduire la biodisponibilité et les concentrations plasmatiques du géfitinib et par conséquent en diminuer l'efficacité. Les antiacides pris régulièrement dans un intervalle de temps rapproché avec l'administration d'Iressa peuvent avoir un effet similaire (cf Interactions, Pharmacocinétique).
- Les données des essais cliniques de phase II, avec utilisation concomitante du géfitinib et de vinorelbine, montrent que le géfitinib pourrait augmenter l'effet neutropéniant de la vinorelbine.
- Lactose :
- Iressa contient du lactose. Les patients souffrant de troubles héréditaires rares d'intolérance au galactose, de déficit en Lapp lactase ou de malabsorption du glucose-galactose, ne doivent pas prendre ce médicament.
- Précautions d'emploi complémentaires :
- Il faut recommander aux patients de demander immédiatement un avis médical s'ils développent :
- des symptômes oculaires ;
- une diarrhée sévère ou persistante, des nausées, des vomissements ou une anorexie qui pourraient indirectement entraîner à une déshydratation.
- des symptômes oculaires ;
- Ces symptômes doivent être pris en charge selon l'état clinique (cf Effets indésirables).
- Dans un essai de phase I/II évaluant l'utilisation du géfitinib et de la radiothérapie dans une population pédiatrique, avec des patients nouvellement diagnostiqués avec une tumeur gliale cérébrale ou une tumeur gliale supratentorielle incomplètement réséquée, 4 cas (1 fatal) d'hémorragie du système nerveux central (SNC) ont été rapportés parmi 45 enfants inclus. Dans le cadre d'un essai clinique avec géfitinib en monothérapie, un autre cas d'hémorragie du SNC a été observé chez un enfant souffrant d'un épendymome.
- Une augmentation du risque d'hémorragie cérébrale chez les patients adultes présentant un CBNPC et recevant du géfitinib n'a pas été établie.
- Des perforations gastro-intestinales ont été rapportées chez des patients prenant Iressa. Dans la plupart des cas, elles étaient associées à d'autres facteurs de risque connus, incluant l'administration concomitante de médicaments tels que des stéroïdes ou des AINS, des antécédents d'ulcères gastro-intestinaux, l'âge, le tabagisme ou des métastases intestinales au niveau de la perforation.
INTERACTIONS |
Le métabolisme du géfitinib se fait via l'isoenzyme CYP 3A4 du cytochrome P450 (principalement) et via le CYP 2D6.
- Substances actives pouvant augmenter les concentrations plasmatiques du géfitinib :
- Les études in vitro ont montré que le géfitinib est un substrat de la p-glycoprotéine (P-gp). Les données disponibles ne suggèrent pas d'impact clinique de ce résultat in vitro.
- Les substances qui inhibent le CYP 3A4 peuvent diminuer la clairance du géfitinib. L'administration concomitante avec des inhibiteurs puissants de l'activité du CYP 3A4 (exemple : kétoconazole, posaconazole, voriconazole, inhibiteurs de protéase, clarithromycine, télithromycine) peut augmenter les concentrations plasmatiques du géfitinib. L'augmentation peut avoir un effet clinique significatif quand des effets indésirables sont liés à la dose et à la durée d'exposition. L'augmentation peut être plus élevée chez les patients avec un génotype métaboliseur lent du CYP 2D6. Un traitement préalable avec l'itraconazole (un inhibiteur puissant du CYP 3A4) entraîne une augmentation de 80 % de l'aire sous la courbe moyenne du géfitinib chez les volontaires sains. Dans les situations d'un traitement concomitant avec des inhibiteurs puissants du CYP 3A4, le patient doit être surveillé étroitement pour les effets indésirables du géfitinib.
- Il n'existe aucune donnée concernant un traitement concomitant avec un inhibiteur du CYP 2D6, mais les inhibiteurs puissants de cette enzyme peuvent entraîner une augmentation d'environ 2 fois les concentrations plasmatiques du géfitinib chez les métaboliseurs rapides du CYP2D6 (cf Pharmacocinétique). Si un traitement concomitant avec un inhibiteur puissant du CYP 2D6 est initié, le patient doit être surveillé étroitement pour les effets indésirables.
- Substances actives pouvant diminuer la concentration plasmatique du géfitinib :
- Les substances qui ont une activité inductrice du CYP 3A4 peuvent augmenter le métabolisme et diminuer les concentrations plasmatiques du géfitinib et par conséquent diminuer l'efficacité d'Iressa. Un traitement concomitant inducteur du CYP 3A4 (exemple : phénytoïne, carbamazépine, rifampicine, barbituriques ou millepertuis [hypericum perforatum]) doit être évité. Un traitement préalable avec la rifampicine (un inducteur puissant du CYP 3A4) entraîne une réduction de 83 % de l'aire sous la courbe moyenne chez les volontaires sains (cf Mises en garde et Précautions d'emploi).
- Les substances qui entraînent une augmentation significative et durable du pH gastrique peuvent diminuer les concentrations plasmatiques du géfitinib et par conséquent diminuer l'efficacité d'Iressa. De fortes doses d'antiacides à courte durée d'action pourraient entraîner le même effet si pris régulièrement dans un intervalle de temps rapproché avec l'administration d'Iressa. L'administration concomitante du géfitinib avec la ranitidine à une dose provoquant une élévation du pH gastrique >= 5 entraîne une diminution de l'aire sous la courbe moyenne de 47 % du géfitinib chez les volontaires sains (cf Mises en garde et Précautions d'emploi, Pharmacocinétique).
- Substances actives pouvant avoir leurs concentrations plasmatiques altérées par le géfitinib :
- Des études in vitro ont montré que le géfitinib a un potentiel limité à inhiber le CYP 2D6. Lors d'études cliniques réalisées chez des patients, le géfitinib a été coadministré avec le métoprolol (substrat du CYP 2D6). Cela a résulté en une augmentation de 35 % de l'exposition au métoprolol. Une telle augmentation pourrait potentiellement être significative pour les substrats du CYP 2D6 avec un index thérapeutique étroit. Lorsque l'utilisation des substrats du CYP 2D6 est envisagé en association avec le géfitinib, une modification de la dose du substrat du CYP 2D6 doit être envisagée en particulier pour les produits présentant une fenêtre thérapeutique étroite.
- In vitro, le géfitinib inhibe la protéine de transport BCRP, mais la signification clinique de ce résultat est inconnue.
- Autres interactions potentielles :
- Une augmentation de l'INR et/ou des épisodes hémorragiques ont été décrits chez certains patients prenant de façon concomitante de la warfarine (cf Mises en garde et Précautions d'emploi).
FERTILITÉ/GROSSESSE/ALLAITEMENT |
Les femmes en âge de procréer doivent être incitées à ne pas être enceintes pendant le traitement.
Grossesse :
Il n'existe pas de données relatives à l'utilisation du géfitinib chez la femme enceinte. Des études chez l'animal ont mis en évidence une toxicité sur la fonction de reproduction (cf Sécurité préclinique). Le risque potentiel chez l'être humain est inconnu. Iressa ne doit pas être utilisé pendant la grossesse sauf si indispensable.
Allaitement :
Le passage de géfitinib dans le lait maternel est inconnu. Le géfitinib et ses métabolites s'accumulent dans le lait maternel chez la rate (cf Sécurité préclinique). Iressa est contre-indiqué en cas d'allaitement ; de ce fait, l'allaitement doit être arrêté pendant le traitement par Iressa (cf Contre-indications)
CONDUITE et UTILISATION DE MACHINES |
EFFETS INDÉSIRABLES |
Des affections pulmonaires interstitielles (API) sont survenues chez 1,3 % des patients, souvent sévères (CTC grade 3-4). Des cas avec évolution fatale ont été rapportés.
Le profil de tolérance présenté dans le tableau 1 est issu du programme de développement clinique du géfitinib et de l'expérience après commercialisation. Les effets indésirables ont été classés par catégories de fréquence dans le tableau 1 sur la base de l'incidence d'effets indésirables comparables rapportés dans la base de données regroupant les essais cliniques de phase III ISEL, INTEREST et IPASS (2462 patients traités par Iressa).
Les fréquences d'apparition des effets indésirables sont définies comme suit : très fréquent (>= 1/10) ; fréquent (>= 1/100 à < 1/10) ; peu fréquent (>= 1/1000 à < 1/100) ; rare (>= 1/10 000 à < 1/1000) ; très rare (< 1/10 000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Au sein de chaque groupe de fréquence, les effets indésirables sont présentés suivant un ordre décroissant de gravité.
| Effets indésirables par système/organe et par fréquence | ||
| Troubles du métabolisme et de la nutrition | Très fréquent | Anorexie, légère ou modérée (CTC grade 1 ou 2) |
| Affections oculaires | Fréquent | Conjonctivite, blépharite et sécheresse oculaire*, généralement d'intensité légère (CTC grade 1) |
| Peu fréquent | Érosion de la cornée, réversible et parfois associée à une pousse aberrante des cils | |
| Affections vasculaires | Fréquent | Hémorragie, tels qu'épistaxis et hématurie |
| Affections respiratoires, thoraciques et médiastinales | Fréquent | Affections pulmonaires interstitielles (1,3 %), souvent sévères (CTC grade 3-4) Des cas d'évolution fatale ont été rapportés |
| Affections gastro- intestinales | Très fréquent | Diarrhée, généralement légère à modérée (CTC grade 1 ou 2) |
| Vomissements, généralement d'intensité légère à modérée (CTC grade 1 ou 2) | ||
| Nausées, généralement d'intensité légère (CTC grade 1) | ||
| Stomatite, essentiellement d'intensité légère (CTC grade 1) | ||
| Fréquent | Déshydratation, secondaire à des diarrhées, nausées, vomissements ou anorexie | |
| Bouche sèche*, essentiellement d'intensité légère (CTC grade 1) | ||
| Peu fréquent | Pancréatite, perforation gastro-intestinale | |
| Affections hépatobiliaires | Très fréquent | Augmentations de l'alanine aminotransférase (ALAT), essentiellement légères à modérées |
| Fréquent | Augmentations de l'aspartate aminotransférase (ASAT), essentiellement légères à modérées Augmentations de la bilirubine totale, essentiellement légères à modérées |
|
| Peu fréquent | Hépatite*** | |
| Affections de la peau et du tissu sous-cutané | Très fréquent | Réactions cutanées, généralement une éruption pustuleuse légère à modérée (CTC grade 1 ou 2), parfois prurit avec sécheresse cutanée, incluant des fissures, sur une base érythémateuse |
| Fréquent | Affections unguéales | |
| Alopécie | ||
| Peu fréquent | Réactions allergiques**, incluant des angioedèmes et de l'urticaire | |
| Rare | Éruptions bulleuses incluant nécrolyse épidermique toxique, syndrome de Stevens-Johnson et érythème polymorphe | |
| Vascularite cutanée | ||
| Affections du rein et des voies urinaires | Fréquent | Augmentation asymptomatique de la créatininémie |
| Protéinurie | ||
| Cystite | ||
| Rare | Cystite hémorragique | |
| Troubles généraux | Très fréquent | Asthénie, essentiellement légère (CTC grade 1) |
| Fréquent | Fièvre | |
** L'incidence globale des effets indésirables (EI) de type allergique était de 1,5 % (36 patients) dans l'analyse regroupant les essais ISEL, INTEREST et IPASS. 14 des 36 patients ont été exclus du calcul de la fréquence rapportée parce que les observations contenaient la preuve d'une étiologie non allergique ou d'une réaction allergique due à un autre médicament.
*** Cela inclut des cas isolés d'insuffisance hépatique qui ont, dans certains cas, conduit à une issue fatale.
- Affections pulmonaires interstitielles (API) :
- Dans l'étude INTEREST, l'incidence rapportée des événements de type API était de 1,4 % (10 patients) dans le groupe géfitinib versus 1,1 % (8 patients) dans le groupe docétaxel. Un événement de type API a eu une issue fatale chez un patient ayant reçu du géfitinib.
- Dans l'étude ISEL, l'incidence des événements de type API était dans la population globale de l'étude approximativement de 1 % dans les deux bras de traitement. La majorité des événements de type API a été rapportée chez des patients d'origine asiatique et l'incidence des API étaient approximativement, chez ces patients recevant du géfitinib ou placebo, d'environ 3 % et 4 %, respectivement. Un événement de type affection pulmonaire interstitielle d'évolution fatale est survenue chez un patient sous placebo.
- Dans une étude japonaise de surveillance postcommercialisation (3350 patients), le taux rapporté des événements de type affection pulmonaire interstitielle a été de 5,8 % chez des patients recevant du géfitinib. La proportion des événements de type API avec issue fatale étaient de 38,6 %.
- Dans une étude clinique de phase III en ouvert (IPASS) chez 1217 patients, comparant Iressa à une double chimiothérapie par carboplatine/paclitaxel en première ligne de traitement chez des patients avec un cancer bronchique avancé non à petites cellules en Asie, l'incidence des événements de type API a été de 2,6 % dans le bras Iressa versus 1,4 % dans le bras carboplatine/paclitaxel.
SURDOSAGE |
PHARMACODYNAMIE |
Classe pharmacothérapeutique : Inhibiteurs de protéine kinase (code ATC : L01XE02).
- Mécanisme d'action et effets pharmacodynamiques :
- Le facteur de croissance épidermique (EGF) et son récepteur (EGFR [HER1; ErbB1]) ont été identifiés comme des facteurs importants dans le processus de croissance cellulaire et de prolifération des cellules normales et cancéreuses. La mutation activatrice de l'EGFR dans une cellule cancéreuse est un facteur important dans la croissance de la cellule tumorale en bloquant l'apoptose, en augmentant la production de facteurs angiogéniques et en facilitant les processus de métastases.
- Le géfitinib est une petite molécule inhibitrice sélective de la tyrosine kinase du récepteur du facteur de croissance épidermique et est un traitement efficace pour les patients ayant une tumeur avec mutations activatrices de la tyrosine kinase de l'EGFR quelque soit la ligne de traitement. Aucune activité clinique significative n'a été montrée chez les patients ayant une tumeur sans mutation de l'EGFR.
- Efficacité et sécurité clinique :
-
- Première ligne de traitement :
- L'étude clinique IPASS de phase III en première ligne, randomisée, a été réalisée en Asie (Chine, Hong Kong, Indonésie, Japon, Malaisie, Philippines, Singapour, Taiwan et Thaïlande) chez des patients présentant un CBNPC avancé (stade IIIB ou IV), avec une histologie de type adénocarcinome, anciens fumeurs légers (arrêt >= 15 ans et moins de 10 paquets-années) ou non fumeurs (voir tableau 2).
-
Tableau 2 : Résultats d'efficacité du géfitinib versus carboplatine/paclitaxel dans l'étude IPASS Population
(N)Taux de réponse objective et IC à 95 % de la différence entre les traitements(a) Critère principal
Survie sans progression(a)(b)Survie globale(a)(b)(c) Totale
(1217)43,0 % vs 32,2 %
[5,3 %, 16,1 %]HR 0,74
[0,65, 0,85]
5,7 m vs 5,8 m
p < 0.0001HR 0,91
[0,76, 1,10]
18,6 m vs 17,3 mEGFR muté
(261)71,2 % vs 47,3 %
[12,0 %, 34,9 %]HR 0,48
[0,36, 0,64]
9,5 m vs 6,3 m
p < 0.0001HR 0,78
[0,50, 1,20]
NA vs 19,5 mEGFR non muté
(176)1,1 % vs 23,5 %
[-32,5 %, -13,3 %]HR 2,85
[2,05, 3,98]
1,5 m vs 5,5 m
p < 0.0001HR 1,38
[0,92, 2,09]
12,1 m vs 12,6 m - NA : non atteint ; N : nombre de patients randomisés ; HR : hazard ratio (hazard ratios < 1 en faveur d'Iressa).
-
(a)
Les données fournies comparent IRESSA à carboplatine/paclitaxel
-
(b)
« m » correspond à la médiane en mois. Les chiffres entre crochets représentent un HR avec un intervalle de confiance à 95 %
-
(c)
Issue de la première analyse, le suivi de la survie globale est en cours.
- Les résultats de qualité de vie diffèrent selon le statut de la mutation de l'EGFR. Chez les patients avec mutation de l'EGFR, les patients traités par Iressa ont une amélioration significative de la qualité de vie et des symptômes du cancer pulmonaire versus carboplatine/paclitaxel (voir tableau 3).
-
Tableau 3 : Résultats de qualité de vie pour le géfitinib versus carboplatine/paclitaxel dans l'étude IPASS Population
(N)FACT-L QdV taux d'amélioration(a)
%LCS
taux d'amélioration des symptômes(a)
%Totale
(1151)(48,0 % vs 40,8 %)
p = 0,0148(51,5 % vs 48,5 %)
p = 0,3037EGFR muté
(259)(70,2 % vs 44,5 %)
p < 0,0001(75,6 % vs 53,9 %)
p = 0,0003EGFR non muté
(169)(14,6 % vs 36,3 %)
p = 0,0021(20,2 % vs 47,5 %)
p = 0,0002 - Les résultats de l'index TOI (Trial Outcome Index) étaient en cohérence avec les données du FACT-L et du LCS.
- QdV : qualité de vie ; FACT-L (Functional Assessment of Cancer Therapy-Lung) : évaluation fonctionnelle dans le traitement du cancer du poumon ; LCS (Lung Cancer Subscale) : échelle d'évaluation du cancer du poumon.
-
(a)
Les données fournies comparent Iressa à carboplatine/paclitaxel.
-
- Patients préalablement traités :
- L'étude clinique randomisée de phase III INTEREST a été conduite chez des patients présentant un cancer bronchique non à petites cellules localement avancé ou métastatique et ayant reçu préalablement une chimiothérapie à base de sels de platine. Dans la population totale, aucune différence statistiquement significative n'a été observée entre le géfitinib et le docétaxel (75 mg/m2) pour la survie globale, la survie sans progression et le taux de réponse objective (voir tableau 4).
-
Tableau 4 : Résultats d'efficacité pour le géfitinib versus docétaxel dans l'étude INTEREST Population
(N)Taux de réponse objective et IC à 95 % de la différence entre les traitements(a) Survie sans progression(a)(b) Critère principal
Survie globale(a)(b)Totale
(1466)9,1 % vs 7,6 %
[-1,5 %, 4,5 %]HR 1,04
[0,93, 1,18]
2,2 m vs 2,7 m
p = 0,4658HR 1,020
[0,905, 1,150](c)
7,6 m vs 8,0 m
p = 0,7332EGFR muté
(44)42,1 % vs 21,1 %
[-8,2 %, 46,0 %]HR 0,16
[0,05, 0,49]
7,0 m vs 4,1 m
p = 0,0012HR 0,83
[0,41, 1,67]
14,2 m vs 16,6 m
p = 0,6043EGFR non muté
(253)6,6 % vs 9,8 %
[-10,5 %, 4,4 %]HR 1,24
[0,94, 1,64]
1,7 m vs 2,6 m
p = 0,1353HR 1,02
[0,78, 1,33]
6,4 m vs 6,0 m
p = 0,9131Asiatiques(c)
(323)19,7 % vs 8,7 %
[3,1 %, 19,2 %]HR 0,83
[0,64, 1,08]
2,9 m vs 2,8 m
p = 0,1746HR 1,04
[0,80, 1,35]
10,4 m vs 12,2 m
p = 0,7711Non Asiatiques
(1143)6,2 % vs 7,3 %
[-4,3 %, 2,0 %]HR 1,12
[0,98, 1,28]
2,0 m vs 2,7 m
p = 0,1041HR 1,01
[0,89, 1,14]
6,9 m vs 6,9 m
p = 0,9259 - N : nombre de patients randomisé ; HR : hazard ratio (hazard ratios < 1 en faveur d'Iressa).
-
(a)
Les données fournies comparent IRESSA à docétaxel.
-
(b)
« m » correspond aux médianes en mois. Les chiffres entre crochets représentent un HR avec un intervalle de confiance à 96 % pour la survie globale de la population totale ou sinon un HR avec un intervalle de confiance à 95 % pour les autres paramètres.
-
(c)
Intervalle de confiance intégralement en dessous de la borne de non infériorité de 1,154.
- Figures 1 et 2 : Résultats d'efficacité du sous groupe des patients non asiatiques dans l'étude I INTEREST (N patients = nombre de patients randomisés)
-
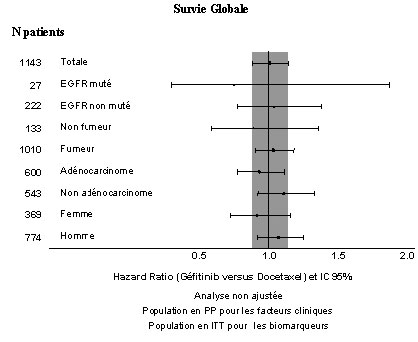
-
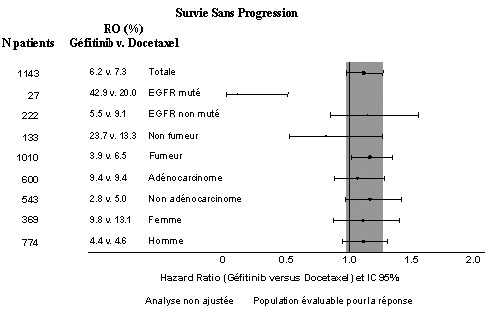
- L'étude clinique randomisée de phase III ISEL a été réalisée chez des patients ayant un CBNPC qui avaient reçu préalablement une ou plusieurs lignes de chimiothérapie et étaient réfractaires ou intolérants à leur dernier traitement. Géfitinib plus traitement symptomatique optimal (Best Supportive Care) a été comparé au placebo plus traitement symptomatique optimal. IRESSA n'a pas prolongé la survie dans la population globale.
- Les résultats de survie diffèrent suivant le statut fumeur et l'origine ethnique (voir tableau 5).
-
Tableau 5 : Résultats d'efficacité pour le géfitinib versus placebo dans l'étude ISEL Population
(N)Taux de réponse objective et IC à 95 % de la différence entre les traitements(a) Temps jusqu'à échec du traitement(a)(b) Critère principal
Survie globale(a)(b)(c)Totale
(1692)8,0 % vs 1,3 %
[4,7 %, 8,8 %]HR 0,82
[0,73, 0,92]
3,0 m vs 2,6 m
p = 0,0006HR 0,89
[0,77, 1,02]
5,6 m vs 5,1 m
p = 0,0871EGFR muté
(26)37,5 % vs 0 %
[-15,1 %, 61,4 %]HR 0,79
[0,20, 3,12]
10,8 m vs 3,8 m
p = 0,7392HR NC
NA vs 4,3 mEGFR non muté
(189)2,6 % vs 0 %
[-5,6 %, 7,3 %]HR 1,10
[0,78, 1,56]
2,0 m vs 2,6 m
p = 0,5771HR 1,16
[0,79, 1,72]
3,7 m vs 5,9 m
p = 0,4449Non fumeur
(375)18,1 % vs 0 %
[12,3 %, 24,0 %]HR 0,55
[0,42, 0,72]
5,6 m vs 2,8 m
p < 0,0001HR 0,67
[0,49, 0,92]
8,9 m vs 6,1 m
p = 0,0124Fumeur
(1317)5,3 % vs 1,6 %
[1,4 %, 5,7 %]HR 0,89
[0,78, 1,01]
2,7 m vs 2,6 m
p = 0,0707HR 0,92
[0,79, 1,06]
5,0 m vs 4,9 m
p = 0,2420Asiatiques(d)
(342)12,4 % vs 2,1 %
[4,0 %, 15,8 %]HR 0,69
[0,52, 0,91]
4,4 m vs 2,2 m
p = 0,0084HR 0,66
[0,48, 0,91]
9,5 m vs 5,5 m
p = 0,0100Non Asiatiques
(1350)6,8 % vs 1,0 %
[3,5 %, 7,9 %]HR 0,86
[0,76, 0,98]
2,9 m vs 2,7 m
p = 0,0197HR 0,92
[0,80, 1,07]
5,2 m vs 5,1 m
p = 0,2942 - N : nombre de patients randomisés ; NC : non calculé, pour le HR de la survie globale si le nombre d'événements est trop faible ; NA : non atteint ; HR : hazard ratio (hazard ratios < 1 en faveur d'Iressa).
-
(a)
Les données fournies comparent IRESSA au placebo.
-
(b)
« m » correspond aux médianes en mois. Les chiffres entre crochets représentent un HR avec un intervalle de confiance à 95 %
-
(c)
Test du log-rank stratifié pour la population totale, sinon utilisation du modèle de cox à hasards proportionnels.
-
(d)
L'origine asiatique exclut les patients d'origine indienne et se base sur l'origine raciale d'un groupe de patients et non nécessairement son lieu de naissance.
-
- Statut de la mutation de l'EGFR et caractéristiques cliniques :
- Les caractéristiques cliniques du patient telles que le statut non fumeur, une histologie de type adénocarcinome et le sexe féminin, sont des facteurs prédictifs indépendants de la présence d'une mutation de l'EGFR dans une analyse multivariée chez 786 patients caucasiens à partir des études réalisées avec le géfitinib* (voir tableau 6). Les patients asiatiques ont aussi une incidence plus élevée de tumeurs avec une mutation de l'EGFR.
-
Tableau 6 : Résumé de l'analyse multivariée par régression logistique pour l'identification des facteurs prédictifs indépendants de la présence de la mutation de l'EGFR chez 786 patients caucasiens* Facteurs prédictifs de la présence de la mutation EGFR Odds Ratio de la présence de la mutation EGFR Valeur prédictive (9,5 % de la population totale présente la mutation de l'EGFR [M+]) Tabagisme
(p < 0,0001)6,5 fois plus élevé chez les non-fumeurs que chez les fumeurs 28/70 (40 %) des non-fumeurs sont mutés (M+)
47/716 (7 %) des fumeurs sont mutés (M+)Histologie
(p < 0,0001)4,4 fois plus élevé chez les adénocarcinomes que chez les non-adénocarcinomes 63/396 (16 %) des patients avec une histologie de type adénocarcinome sont mutés (M+)
12/390 (3 %) des patients avec une histologie de type non adénocarcinome sont mutés (M+)Sexe
(p = 0,0397)1,7 fois plus élevé chez les femmes que chez les hommes 40/235 (17 %) des femmes sont mutées (M+)
35/551 (6 %) des hommes sont mutés (M+) -
*
à partir des études suivantes : INTEREST, ISEL, INTACT 1 et 2, IDEAL 1 et 2, INVITE.
PHARMACOCINÉTIQUE |
- Absorption :
- Après administration orale du géfitinib, l'absorption est modérément lente et le pic des concentrations plasmatiques de géfitinib est généralement atteint en 3 à 7 heures. La biodisponibilité absolue moyenne est de 59 % chez les patients cancéreux. La prise de nourriture est sans effet significatif sur l'exposition au géfitinib. Dans un essai réalisé auprès de volontaires sains dont le pH gastrique a été maintenu au-dessus de 5, l'exposition au géfitinib a été réduite de 47 %, vraisemblablement liée à une solubilité réduite du géfitinib dans l'estomac (cf Mises en garde et Précautions d'emploi, Interactions).
- Distribution :
- Le géfitinib présente un volume de distribution moyen à l'équilibre de 1400 l, témoignant d'une diffusion tissulaire importante. La fixation aux protéines plasmatiques est de l'ordre de 90 %. Le géfitinib se lie à l'albumine sérique et à l'alpha1-glycoprotéine acide.
- Les données in vitro montre que le géfitinib est un substrat de la protéine de transport membranaire P-gp.
- Métabolisme :
- Les données in vitro montrent que le CYP 3A4 et le CYP 2D6 sont les principaux iso-enzymes du cytochrome P450 impliqué dans le métabolisme oxydatif du géfitinib.
- Les études in vitro ont montré que le géfitinib a un potentiel limité d'inhibition du CYP 2D6. Le géfitinib n'a montré chez l'animal aucun effet d'induction enzymatique et aucune inhibition significative de toute autre isoenzyme du cytochrome P450 (in vitro).
- Chez l'homme, le géfitinib est fortement métabolisé. 5 métabolites ont été complètement identifiés dans les excrétions et 8 métabolites dans le plasma. Le métabolite principal est l'O-desméthyl géfitinib dont le pouvoir inhibiteur de la prolifération cellulaire stimulée par l'EGFR s'avère 14 fois moins puissant que celui du géfitinib et il n'a pas d'effet inhibiteur sur la croissance de la cellule tumorale chez la souris. Par conséquent, sa contribution à l'activité clinique du géfitinib est donc peu probable.
- Il a été montré in vitro que l'O-desméthyl géfitinib est produit via le CYP 2D6. Le rôle du CYP 2D6 dans la clairance métabolique du géfitinib a été évalué dans un essai clinique chez des volontaires sains génotypés pour le statut CYP 2D6. Chez les métaboliseurs lents, il n'a pas été observé de production mesurable d'O-desméthyl géfitinib. Les spectres d'exposition du géfitinib obtenus à la fois chez les métaboliseurs lents et rapides étaient larges et se chevauchaient, mais la moyenne de l'exposition du géfitinib est 2 fois plus élevée dans le groupe des métaboliseurs lents. Les moyennes les plus hautes des expositions susceptibles d'être atteintes chez les patients sans activité du CYP 2D6 pourraient être cliniquement significatives, sachant que les effets indésirables dépendent de la dose et de l'exposition.
- Élimination :
- Le géfitinib est principalement excrété sous forme de métabolites dans les fèces, avec une élimination rénale du géfitinib et de ses métabolites qui représente moins de 4 % de la dose administrée.
- La clairance plasmatique totale du géfitinib est de l'ordre de 500 ml/min et la demi-vie terminale moyenne est de 41 heures chez les patients cancéreux. L'administration, répétée de géfitinib une fois par jour se traduit par une accumulation d'un facteur de 2 à 8 avec un état d'équilibre atteint après 7 à 10 doses. A l'état d'équilibre, les concentrations plasmatiques se maintiennent dans les limites d'un facteur de 2 à 3 sur l'intervalle de 24 heures entre deux administrations.
- Populations particulières :
- D'après les analyses de pharmacocinétique de données de population réalisées chez des patients cancéreux, aucune relation n'a été identifiée entre la concentration prévisible à l'équilibre et l'âge des patients, le poids, le sexe, l'origine ethnique ou la clairance de la créatinine (au-dessus de 20 ml/min).
- Insuffisance hépatique :
- Dans une étude clinique de phase I, ouverte, à la dose unique de 250 mg de géfitinib, chez des patients présentant une insuffisance hépatique légère, modérée ou sévère liée à une cirrhose (suivant la classification de Child-Pugh), il y a eu une augmentation de l'exposition dans tous ces groupes par rapport au sujet sain. Chez les patients présentant une insuffisance hépatique légère, modérée ou sévère, une augmentation moyenne de 3,1 fois de l'exposition au géfitinib a été observée. Aucun de ces patients n'avait un cancer, tous avaient une cirrhose et quelques uns avaient une hépatite.
- Cette augmentation pourrait être cliniquement significative sachant que les effets indésirables dépendent de la dose et de l'exposition au géfitinib.
- Le géfitinib a été évalué dans un essai clinique chez 41 patients présentant une tumeur solide, avec une fonction hépatique normale ou une insuffisance hépatique modérée ou sévère (classée selon le grade CTC à l'inclusion pour l'ASAT, les phosphatases alcalines et la bilirubine) due à des métastases hépatiques. Suite à une administration quotidienne de 250 mg de géfitinib, le temps d'atteinte à l'état d'équilibre, la clairance plasmatique totale (CmaxSS) et l'exposition à l'équilibre (ASC24SS) ont été similaires dans les groupes présentant une insuffisance hépatique modérée et une fonction hépatique normale. Les données de 4 patients avec une insuffisance hépatique sévère liée à la présence de métastases hépatiques suggèrent que les expositions à l'état d'équilibre sont également similaires à celles des patients à fonction hépatique normale.
SÉCURITE PRÉCLINIQUE |
- atrophie de l'épithélium de la cornée et translucidité cornéale ;
- nécrose papillaire rénale ;
- nécrose hépatocellulaire et infiltration des sinusoïdes par des macrophages à coloration éosinophile.
Les données in vitro indiquent que le géfitinib a un potentiel d'inhibition de la repolarisation cardiaque (par exemple l'intervalle QT). La signification clinique de ces observations est inconnue.
Une diminution de la fertilité chez la rate a été observée à la dose de 20 mg/kg/jour.
Des études publiées ont montré que, chez les souris génétiquement modifiées, une absence d'expression de l'EGFR entraîne une anomalie du développement liée à une immaturité épithéliale sur une variété d'organes dont la peau, le tractus gastro-intestinal et les poumons. Lors de l'administration du géfitinib au cours de l'organogenèse, il n'y a eu aucun effet sur le développement embryofoetal chez le rat à la plus haute dose (30 mg/kg/jour). Cependant chez le lapin, il y a eu une diminution des poids des foetus à la dose de 20 mg/kg/jour et au-delà. Aucune malformation induite par le géfitinib n'a été rapportée chez les espèces étudiées. Lors de l'administration chez la rate au cours de la gestation et de la mise bas, il y a eu une diminution de la survie de la portée à la dose de 20 mg/kg/jour.
Après administration orale du géfitinib marqué au C-14 à des rates allaitantes 14 jours post-partum, les concentrations de la radioactivité dans le lait étaient 11 à 19 fois plus élevées que dans le sang.
Le géfitinib n'a montré aucun potentiel génotoxique.
Une étude de carcinogénicité de 2 ans chez le rat a montré une petite mais significative augmentation de l'incidence des adénomes hépatocellulaires chez le mâle et la femelle rats et des hémangiosarcomes des ganglions lymphatiques mésentériques chez la rate à la plus haute dose (10 mg/kg/jour) seulement. Les adénomes hépatocellulaires ont été également observés dans une étude de carcinogénicité de 2 ans chez la souris ; cette étude a montré une petite augmentation de l'incidence de ce résultat chez la souris mâle à la demi dose, et à la fois chez la souris mâle et femelle à la dose la plus élevée. Ces effets ont atteint le seuil de significativité chez la souris femelle mais non chez le mâle. Les doses sans effet utilisées chez la souris et le rat ne correspondaient pas aux doses utilisées en clinique. La signification clinique de ces observations est inconnue.
Les résultats d'une étude in vitro de phototoxicité ont montré que le géfitinib peut avoir un potentiel phototoxique.
MODALITÉS DE CONSERVATION |
- Durée de conservation :
- 4 ans.
A conserver dans le conditionnement d'origine pour protéger de l'humidité.
MODALITÉS MANIPULATION/ÉLIMINATION |
Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| Médicament soumis à prescription hospitalière. | |
| Prescription réservée aux spécialistes en oncologie ou en hématologie ou aux médecins compétents en cancérologie. | |
| Médicament nécessitant une surveillance particulière pendant le traitement. | |
| AMM | EU/1/09/526/002 ; CIP 3400939595078 (RCP rév 26.11.2010). |
| Prix : | 2272.50 euros (30 comprimés). |
|
Remb Séc soc à 100 % dans l'indication de l'AMM aux seuls patients adultes pour lesquels a été effectué un test de détection de mutations activatrices de l'EGFR et qui s'est révélé positif. Collect. |
|
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l'Agence européenne du médicament : http://www.ema.europa.eu.
Titulaire de l'AMM : AstraZeneca AB, S-151 85, Sodertalje, Suède.
AstraZeneca
1, place Renault. 92844 Rueil-Malmaison cdx
Tél : 01 41 29 40 00. Fax : 01 41 29 40 01
