ABSTRAL®
fentanyl
FORMES et PRÉSENTATIONS |
Comprimé sublingual à 200 µg (ovale ; blanc) : Boîtes de 10 et de 30, sous plaquettes thermoformées.
Comprimé sublingual à 300 µg (triangulaire ; blanc) : Boîtes de 10 et de 30, sous plaquettes thermoformées.
Comprimé sublingual à 400 µg (en forme de losange ; blanc) : Boîtes de 10 et de 30, sous plaquettes thermoformées.
Comprimé sublingual à 600 µg (en forme de « D » ; blanc) : Boîte de 30, sous plaquettes thermoformées.
Comprimé sublingual à 800 µg (oblong ; blanc) : Boîte de 30, sous plaquettes thermoformées.
COMPOSITION |
| p cp | |
| Fentanyl (DCI) citrate exprimé en fentanyl | 100 µg |
| ou | 200 µg |
| ou | 300 µg |
| ou | 400 µg |
| ou | 600 µg |
| ou | 800 µg |
INDICATIONS |
POSOLOGIE ET MODE D'ADMINISTRATION |
Les comprimés sublinguaux d'Abstral doivent être placés directement sous la langue, le plus loin possible. Les comprimés sublinguaux d'Abstral ne doivent pas être avalés, mais fondre complètement sous la langue, sans être mâchés, ni sucés. Les patients doivent être informés qu'ils ne doivent pas manger ni boire avant dissolution complète du comprimé sublingual.
Les patients souffrant de sécheresse buccale peuvent utiliser de l'eau pour humidifier la muqueuse buccale avant la prise d'Abstral.
- Titration de la dose :
- L'objectif de la titration de la dose est d'identifier une dose d'entretien optimale pour le traitement des accès douloureux paroxystiques. Cette dose optimale doit permettre une analgésie adéquate avec un taux acceptable d'effets indésirables.
- La dose optimale d'Abstral doit être déterminée pour chaque patient par titration progressive. Plusieurs dosages sont disponibles et peuvent être utilisés pendant la phase de titration. La dose initiale d'Abstral utilisée doit être de 100 µg, avec augmentation de la posologie si nécessaire, dans la gamme des dosages disponibles.
- Les patients doivent être surveillés attentivement jusqu'à ce qu'une dose optimale ait été atteinte.
- La substitution d'Abstral à d'autres produits contenant du fentanyl ne doit pas être effectuée dans un rapport de 1/1 dans la mesure où les différents produits ont des profils d'absorption différents. Tout remplacement d'un autre produit contenant du fentanyl par Abstral doit donner lieu à une nouvelle titration.
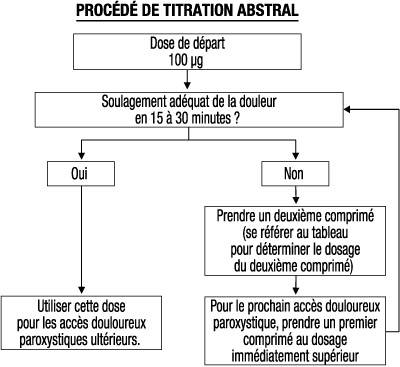
- Le schéma posologique suivant est recommandé pour la titration. Le médecin doit toutefois toujours prendre en compte les besoins cliniques du patient, son âge et ses maladies concomitantes.
- Tous les patients doivent initier le traitement par un seul comprimé sublingual de 100 µg. Si une analgésie adéquate n'est pas obtenue dans les 15 à 30 minutes suivant l'administration du comprimé sublingual, un comprimé sublingual supplémentaire (deuxième) de 100 µg peut être administré. Si une analgésie adéquate n'est pas obtenue dans les 15 à 30 minutes suivant la première dose, pour le traitement du prochain accès douloureux paroxystique il faudra envisager d'administrer le dosage supérieur (cf Figure ci-dessous). L'augmentation posologique doit se poursuivre par étape jusqu'à obtention d'une analgésie adéquate. Pour des doses (comprimés) initiales de 400 µg et plus, le dosage du comprimé sublingual supplémentaire (deuxième) doit être de 200 µg. Cela est illustré par le tableau ci-dessous.
- Pendant la phase de titration, le nombre maximal de comprimés sublinguaux administrés pour un seul accès douloureux paroxystique ne doit pas être supérieur à deux (2).
-
-
Dosage (en µg) du premier comprimé sublingual par accès douloureux paroxystique Dosage (en µg) du second comprimé sublingual, à administrer au besoin 15 à 30 minutes après le premier comprimé 100 100 200 100 300 100 400 200 600 200 800 - - Si la plus forte dose permettant d'obtenir une analgésie efficace provoque des effets indésirables considérés comme inacceptables, une dose intermédiaire peut être administrée (en utilisant selon le cas le comprimé de 100 µg).
- Les doses supérieures à 800 µg n'ont pas été évaluées au cours des études cliniques.
- Afin de minimiser le risque d'effet indésirable lié aux morphiniques et de déterminer la dose appropriée, les patients doivent être placés sous surveillance médicale stricte pendant le processus de titration.
- Traitement d'entretien :
- Lorsque la dose appropriée, qui peut être supérieure à un comprimé, a été déterminée, elle doit continuer à être utilisée ; la consommation doit être limitée à 4 doses d'Abstral par jour.
- Réajustement de la dose :
- En cas d'observation d'une modification marquée de la réponse (analgésie ou effets indésirables), une nouvelle adaptation de la dose peut être nécessaire pour assurer le maintien d'une dose optimale.
- Si le patient présente plus de 4 accès douloureux paroxystiques par jour pendant plus de 4 jours consécutifs, la dose du morphinique à longue durée d'action utilisé pour traiter la douleur chronique doit être réévaluée. En cas de modification de ce morphinique ou de sa posologie, la dose d'Abstral doit être réévaluée et éventuellement réadaptée pour garantir l'utilisation d'une dose optimale.
- Toute nouvelle adaptation de la dose d'un analgésique, quel qu'il soit, doit être impérativement effectuée sous surveillance médicale.
- Arrêt du traitement :
- Lorsque le traitement par morphinique n'est plus nécessaire, la dose d'Abstral doit être prise en compte avant toute réduction progressive des morphiniques, afin de minimiser l'éventuel syndrome de sevrage.
- Chez les patients poursuivant le traitement morphinique de la douleur chronique chez qui le traitement des accès douloureux paroxystiques n'est plus nécessaire, Abstral peut généralement être arrêté immédiatement.
- Utilisation chez l'enfant et l'adolescent :
- Compte tenu de l'absence de données de sécurité et d'efficacité pour cette population, Abstral ne doit pas être utilisé chez les patients de moins de 18 ans.
- Utilisation chez le sujet âgé :
- La titration de la dose doit être particulièrement prudente et l'apparition éventuelle de signes de toxicité du fentanyl doit faire l'objet d'une surveillance stricte (cf Mises en garde et Précautions d'emploi).
- Utilisation chez les patients insuffisants hépatiques ou rénaux :
- L'apparition éventuelle de signes de toxicité du fentanyl doit faire l'objet d'une surveillance stricte chez les patients atteints de troubles hépatiques ou rénaux (cf Mises en garde et Précautions d'emploi).
CONTRE-INDICATIONS |
- Hypersensibilité à la substance active ou à l'un des excipients.
- Sujets n'ayant jamais reçu de traitement morphinique, en raison du risque de dépression respiratoire pouvant mettre en jeu le pronostic vital.
- Dépression respiratoire sévère ou pathologies pulmonaires obstructives sévères.
MISES EN GARDE et PRÉCAUTIONS D'EMPLOI |
- Les patients et le personnel soignant doivent être informés qu'Abstral contient une substance active à une dose qui peut être mortelle pour un enfant. Par conséquent, tous les comprimés doivent être conservés hors de la portée et de la vue des enfants.
- En raison des effets indésirables potentiellement graves des traitements morphiniques comme Abstral, les patients et le personnel soignant doivent être informés de l'importance de la prise correcte d'Abstral et informés des mesures à prendre en présence de symptômes de surdosage.
- Avant l'instauration d'Abstral, le traitement morphinique à longue durée d'action utilisé pour contrôler la douleur chronique doit avoir été stabilisé.
- Une accoutumance et une dépendance physique et/ou psychologique sont susceptibles d'apparaître lors de l'administration répétée de morphiniques tels que le fentanyl. La toxicomanie iatrogène est rare dans le cadre de l'utilisation thérapeutique des morphiniques.
- Comme tous les morphiniques, Abstral est associé à un risque de dépression respiratoire cliniquement significative. La phase de titration doit être réalisée avec une prudence particulière chez les patients atteints de bronchopneumopathie chronique obstructive ou d'une autre pathologie (par exemple, myasthénie grave) les prédisposant à une dépression respiratoire, en raison de la majoration du risque de dépression respiratoire pouvant entraîner un arrêt respiratoire.
- Abstral ne doit être administré qu'avec une extrême prudence aux patients susceptibles de présenter une sensibilité particulière aux effets cérébraux de l'hypercapnie, comme les patients présentant des signes d'hypertension intracrânienne, des troubles de la conscience, un coma ou des tumeurs cérébrales. Les morphiniques pouvant masquer l'évolution clinique chez les patients atteints de traumatismes crâniens, ils ne doivent être utilisés dans ce cadre qu'en cas d'absolue nécessité.
- Administré par voie intraveineuse, le fentanyl peut provoquer une bradycardie. Abstral doit être utilisé avec précaution chez les patients présentant une brady-arythmie.
- Les données obtenues à la suite de l'administration intraveineuse de fentanyl suggèrent la possibilité d'une réduction de sa clairance et d'une augmentation de sa demi-vie chez les patients âgés, qui pourraient être plus sensibles à la substance active que les patients plus jeunes. Les patients âgés, cachectiques ou affaiblis doivent faire l'objet d'une surveillance attentive en cas d'apparition de signes de toxicité du fentanyl, entraînant si nécessaire une réduction de la dose.
- Abstral doit être administré avec prudence chez les patients présentant des troubles hépatiques ou rénaux, en particulier pendant la phase de titration. L'utilisation d'Abstral chez des patients insuffisants hépatiques ou rénaux pourrait augmenter la biodisponibilité du fentanyl et réduire sa clairance systémique, ce qui pourrait entraîner une augmentation et une prolongation des effets morphiniques.
- Une prudence particulière doit être apportée au traitement des patients hypovolémiques ou hypotendus.
- Abstral n'a pas été étudié chez les patients présentant des lésions buccales ou une mucite. Un risque d'augmentation de l'exposition systémique au médicament peut exister chez ces patients et une prudence particulière est donc recommandée pendant la titration.
- La suspension du traitement par Abstral ne devrait pas entraîner d'effet notable, mais les symptômes possibles de sevrage incluent : anxiété, tremblements, sueurs, pâleur, nausées et vomissements.
INTERACTIONS |
- Le fentanyl est métabolisé par le CYP3A4. Les médicaments qui inhibent l'activité du CYP3A4 tels que les macrolides (par exemple, érythromycine), les antifongiques imidazolés (par exemple, kétoconazole, itraconazole) et certains inhibiteurs de la protéase (par exemple, ritonavir) sont susceptibles d'augmenter la biodisponibilité du fentanyl en diminuant sa clairance systémique, ce qui pourrait accroître ou prolonger les effets des morphiniques. Le jus de pamplemousse est également un inhibiteur du CYP3A4. Le fentanyl doit donc être administré avec prudence lorsque des inhibiteurs du CYP3A4 sont administrés de façon concomitante.
- L'administration concomitante d'autres dépresseurs du SNC tels que : autres dérivés morphiniques (analgésiques ou antitussifs), anesthésiques généraux, myorelaxants, antidépresseurs sédatifs, antihistaminiques H1 sédatifs, barbituriques, anxiolytiques (benzodiazépines), hypnotiques, neuroleptiques, clonidine et substances apparentées peuvent augmenter les effets dépresseurs du SNC. Une dépression respiratoire, une hypotension et une sédation profonde peuvent apparaître.
- L'alcool potentialise les effets sédatifs des analgésiques morphiniques. L'administration concomitante de boissons alcoolisées ou de médicaments contenant de l'alcool et d'Abstral n'est donc pas recommandée.
- L'utilisation d'Abstral n'est pas recommandée chez les patients ayant reçu des inhibiteurs de la monoamine-oxydase (IMAO) dans les 14 jours précédant la prise, en raison de la potentialisation sévère et imprévisible des analgésiques morphiniques par les IMAO.
- L'utilisation concomitante d'agonistes-antagonistes partiels morphiniques (par exemple buprénorphine, nalbuphine, pentazocine) n'est pas recommandée. En effet, ceux-ci possèdent une forte affinité pour les récepteurs morphiniques, avec une activité intrinsèque relativement faible ; ils antagonisent donc partiellement l'effet analgésique du fentanyl et peuvent entraîner des symptômes de sevrage chez les patients morphinodépendants.
FERTILITÉ/GROSSESSE/ALLAITEMENT |
Un traitement prolongé au cours de la grossesse est associé à un risque de symptômes de sevrage chez le nouveau-né.
Il est recommandé de ne pas utiliser le fentanyl pendant le travail et l'accouchement (y compris en cas de césarienne), car il franchit la barrière placentaire et peut entraîner une dépression respiratoire chez le foetus ou le nouveau-né.
Le fentanyl est excrété dans le lait maternel et peut entraîner une sédation et une dépression respiratoire chez le nourrisson. Il doit être utilisé pendant l'allaitement, uniquement si le bénéfice attendu dépasse clairement les risques potentiels pour la mère et l'enfant.
CONDUITE et UTILISATION DE MACHINES |
Toutefois, le fentanyl peut altérer les capacités mentales ou physiques nécessaires à l'exécution de tâches potentiellement dangereuses telles que la conduite d'un véhicule ou l'utilisation de machines. Il doit être conseillé aux patients de ne pas conduire de véhicule ni utiliser de machine s'ils éprouvent une somnolence, des étourdissements ou des troubles visuels (vision floue ou double) pendant le traitement par Abstral.
EFFETS INDÉSIRABLES |
Les effets indésirables susceptibles d'être liés au traitement observés chez les patients et volontaires des études cliniques sur Abstral sont énumérés ci-dessous par système de classe d'organe et par fréquence : très fréquent (>= 1/10), fréquent (>= 1/100, < 1/10). Au sein de chaque groupe de fréquence, les effets indésirables sont présentés suivant un ordre décroissant de gravité.
Affections du système nerveux :
- Très fréquent : étourdissements, somnolence, céphalées.
- Fréquent : réactions vasovagales, hypoesthésie, paresthésie, hyperacousie.
- Fréquent : troubles de la vision.
- Fréquent : dépression respiratoire, rhinite, pharyngite.
- Très fréquent : nausées.
- Fréquent : vomissements, douleurs abdominales, diarrhées, constipation, gêne gastrique, dyspepsie, sécheresse buccale.
- Fréquent : rash, prurit.
- Fréquent : hypotension orthostatique, bouffées vasomotrices, bouffées de chaleur.
- Très fréquent : fatigue.
- Fréquent : asthénie, irritation au site d'application.
- Fréquent : dépression, anorexie, troubles de la concentration, euphorie.
Les effets indésirables suivants associés à d'autres produits contenant du fentanyl ont également été rapportés : très fréquent (>= 1/10), fréquent (>= 1/100, < 1/10), peu fréquent (>= 1/1000, < 1/100), rare (>= 1/10 000, < 1/1000), très rare (< 1/10 000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Affections cardiaques :
- Peu fréquent : bradycardie, tachycardie, hypertension.
- Très rare : arythmies.
- Fréquent : myoclonie, insomnie, dysgueusie.
- Peu fréquent : démarche anormale/incoordination, vertiges, amnésie, troubles de la parole, tremblements.
- Peu fréquent : hypoventilation, asthme, dyspnée.
- Très rare : apnée, hémoptysie.
- Fréquent : occlusion gastro-intestinale, dysphagie, ulcération buccale/stomatite, affections linguales.
- Peu fréquent : hypertrophie abdominale, flatulence, soif.
- Rare : hoquet.
- Peu fréquent : rétention urinaire, dysurie.
- Très rare : spasme vésical, oligurie.
- Très fréquent : sueurs.
- Fréquent : lésions accidentelles.
- Fréquent : vasodilatation.
- Peu fréquent : malaise.
- Fréquent : hallucination, état confusionnel, anxiété, nervosité, troubles de la pensée, rêves anormaux.
- Peu fréquent : agitation, dépersonnalisation, labilité émotionnelle.
SURDOSAGE |
Les mesures à prendre immédiatement en présence d'un surdosage morphinique consistent à retirer immédiatement le comprimé sublingual d'Abstral de la bouche du patient s'il s'y trouve encore, effectuer des stimulations physiques et verbales du patient, déterminer son niveau de conscience. La perméabilité des voies respiratoires doit être assurée et une ventilation assistée (assistance respiratoire) doit être instaurée si nécessaire. Une température corporelle adéquate doit être maintenue et un apport liquidien par voie parentérale doit être instauré.
Pour le traitement du surdosage (ingestion accidentelle) chez une personne qui n'a jamais reçu de traitement morphinique, administrer de la naloxone ou d'autres antagonistes morphiniques en se référant aux indications cliniques et au résumé des caractéristiques du produit en question. En cas de dépression respiratoire prolongée, il peut être nécessaire de répéter l'administration de l'antagoniste morphinique.
La naloxone et les autres antagonistes morphiniques doivent être utilisés avec prudence dans le traitement du surdosage chez les patients sous morphiniques en raison du risque de déclenchement d'un syndrome de sevrage aigu.
Une hypotension sévère ou persistante doit évoquer une hypovolémie, à prendre en charge par un apport liquidien approprié par voie parentérale.
Le fentanyl et d'autres morphiniques ont été associés à une rigidité musculaire inhibant la respiration. Dans ce cas, une intubation endotrachéale, l'instauration d'une ventilation assistée et l'administration d'un antagoniste des morphiniques, ainsi que d'un curarisant, peuvent être nécessaires.
PHARMACODYNAMIE |
Classe pharmacothérapeutique : analgésiques, opioïdes, dérivés de la phénylpipéridine (code ATC : N02AB03).
Le fentanyl est un puissant analgésique agissant sur le récepteur morphinique µ et présente un effet analgésique rapide et une courte durée d'action. Le fentanyl présente un effet analgésique environ 100 fois plus puissant que celui de la morphine. Les effets secondaires du fentanyl sur le système nerveux central (SNC) et les fonctions respiratoire et gastro-intestinale sont ceux des analgésiques morphiniques et sont considérés comme des effets de classe.
Les effets analgésiques du fentanyl sont liés aux concentrations plasmatiques en substance active. Chez les sujets n'ayant jamais reçu de traitement morphinique, les concentrations sanguines minimales de fentanyl produisant un effet analgésique efficace sont comprises entre 0,3 et 1,2 ng/ml. Les concentrations comprises entre 10 et 20 ng/ml produisent un effet anesthésique chirurgical et une profonde dépression respiratoire.
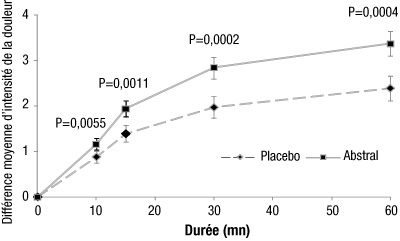
Chez des patients cancéreux dont les douleurs chroniques étaient contrôlées par des administrations régulières de doses stables de morphiniques, une amélioration statistiquement significative a été observée sur la différence d'intensité de la douleur avec Abstral comparativement au placebo, dès 10 minutes après l'administration (cf figure 1 ci-dessous). La nécessité de recourir à un traitement analgésique de secours a été significativement réduite.
| Figure 1 : Différence moyenne d'intensité de la douleur par rapport à la situation initiale (± ET) pour Abstral comparé à un placebo (mesurée sur une échelle de Likert de 0 à 10) |
 |
L'innocuité et l'efficacité d'Abstral ont été évaluées chez des patients prenant le médicament dès l'apparition de l'accès douloureux paroxystique. L'utilisation préventive d'Abstral dans les épisodes douloureux prévisibles n'a pas été étudiée dans les essais cliniques.
Comme tous les agonistes des récepteurs morphiniques µ, le fentanyl provoque une dépression respiratoire dose-dépendante. Le risque est plus élevé chez les sujets n'ayant jamais reçu de traitement morphinique que chez les patients souffrant de douleurs sévères et recevant un traitement morphinique de fond. Le traitement prolongé par morphiniques entraîne généralement le développement d'une accoutumance à leurs effets secondaires.
Bien que les morphiniques augmentent en général la tonicité du muscle lisse urétral, l'effet global est variable, entraînant dans certains cas des urgences mictionnelles et dans d'autres cas une dysurie.
Les morphiniques augmentent la tonicité et réduisent les contractions péristaltiques du muscle lisse intestinal, prolongeant la durée du transit intestinal, pouvant ainsi être à l'origine de l'effet constipant du fentanyl.
PHARMACOCINÉTIQUE |
Le fentanyl est un médicament très lipophile ; il est absorbé très rapidement par la muqueuse buccale et plus lentement par le tractus gastro-intestinal. Administré par voie orale, le fentanyl subit un métabolisme par effets de premier passage hépatique et intestinal prononcés.
Abstral se présente sous la forme de comprimé sublingual à dissolution rapide. Le fentanyl est absorbé rapidement, au cours des 30 minutes suivant l'administration d'Abstral. La biodisponibilité d'Abstral n'a pas été étudiée mais elle est estimée à environ 70 %. Les concentrations plasmatiques maximales moyennes de fentanyl sont comprises entre 0,2 et 1,3 ng/ml (après administration de 100 à 800 µg d'Abstral). Elles sont obtenues respectivement en 22,5 et 240 minutes.
Environ 80 à 85 % du fentanyl se lie aux protéines plasmatiques, essentiellement à l'alpha-1 glycoprotéine et dans une moindre mesure à l'albumine et aux lipoprotéines. Le volume de distribution du fentanyl à l'état d'équilibre est d'environ 3 à 6 l/kg.
Le fentanyl est métabolisé en plusieurs métabolites pharmacologiquement inactifs, notamment en norfentanyl essentiellement sous l'effet du CYP3A4. Après administration intraveineuse de fentanyl, environ 75 % de la dose administrée est excrétée dans les urines dans les 72 heures, essentiellement sous forme de métabolites. Seuls 10 % sont excrétés sous forme inchangée. Environ 9 % de la dose est excrétée dans les selles, essentiellement sous forme de métabolites. La clairance plasmatique totale du fentanyl est d'environ 0,5 l/h/kg. Après administration d'Abstral, la demi-vie d'élimination principale du fentanyl est d'environ 7 heures (3 à 12,5 heures) et sa demi-vie d'élimination terminale d'environ 20 heures (11,5 à 25 heures).
Les paramètres pharmacocinétiques d'Abstral sont dose-proportionnels pour la gamme de dosages disponibles (100 à 800 µg).
- Insuffisance hépatique ou rénale :
- L'insuffisance hépatique ou rénale risque d'entraîner une augmentation des concentrations sériques. La clairance du fentanyl pourrait être réduite chez les patients âgés, cachectiques ou affaiblis, ce qui pourrait entraîner la prolongation de la demi-vie terminale du produit (cf Posologie et Mode d'administration, Mises en garde et Précautions d'emploi).
SÉCURITE PRÉCLINIQUE |
Les données de pharmacologie de sécurité et de toxicologie en administration répétée n'ont pas révélé d'autre risque particulier chez l'homme que ceux indiqués dans les autres rubriques de ce RCP. Des études sur le rat ont montré une réduction de la fertilité et une augmentation de la mortalité embryonnaire. Aucun effet tératogène n'a toutefois été démontré.
Des tests de mutagénicité bactérienne et chez le rongeur ont abouti à des résultats négatifs. Comme d'autres morphiniques, le fentanyl a fait preuve d'effets mutagènes in vitro sur des cellules de mammifères. Il semble improbable que l'utilisation thérapeutique entraîne un risque mutagène puisque les effets ont été induits uniquement à des concentrations très élevées.
Aucune étude de carcinogénicité à long terme n'a été réalisée.
MODALITÉS DE CONSERVATION |
- Durée de conservation :
- 2 ans.
À conserver à une température ne dépassant pas 25 °C, dans l'emballage extérieur d'origine et à l'abri de l'humidité.
MODALITÉS MANIPULATION/ÉLIMINATION |
Les déchets doivent être éliminés en toute sécurité. Les patients et le personnel soignant doivent être incités à retourner tous les produits non utilisés à la pharmacie. Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| Délivrance fractionnée de 7 jours maximum, sauf mention expresse du prescripteur « délivrance en une fois ». | |
| Prescription sur ordonnance répondant aux spécifications fixées par l'arrêté du 31 mars 1999. | |
| AMM | 3400939104294 (2009) 10 cp 100 µg. |
| 3400939104355 (2009) 30 cp 100 µg. | |
| 3400939104416 (2009) 10 cp 200 µg. | |
| 3400939104584 (2009) 30 cp 200 µg. | |
| 3400939104645 (2009) 10 cp 300 µg. | |
| 3400939104706 (2009) 30 cp 300 µg. | |
| 3400939104874 (2009) 10 cp 400 µg. | |
| 3400939104935 (2009) 30 cp 400 µg. | |
| 3400939105185 (2009) 30 cp 600 µg. | |
| 3400939105765 (2009) 30 cp 800 µg. | |
| RCP révisés le 19.07.2010. | |
| Prix : | 74.87 euros (boîtes de 10 comprimés). |
| 211.99 euros (boîtes de 30 comprimés). | |
| Remb Séc soc à 65 %. Collect. | |
Titulaire de l'AMM : Prostrakan Limited, Galabank Business Park, TD 1 1QH Galashiels, Royaume-Uni.
PROSTRAKAN Pharma
1, rue Royale. 92210 Saint-Cloud
Tél : 01 55 39 14 30. Fax : 01 55 39 14 31
